胎仔期から発症する腎不全モデルを作製することは困難だった
東京慈恵会医科大学は3月18日、高効率・迅速・安全な手法による腎不全モデルマウスの開発に成功と発表した。この研究は、同大腎臓・高血圧内科の松井賢治助教、横尾隆教授、山中修一郎助教(兼任:プロジェクト研究部腎臓応用再生医学研究室 室長)らの研究グループによるもの。研究成果は、「Nature Communications」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
慢性腎臓病(CKD)は、日本国内に約1330万人の患者がいるとされる国民病であり、進行すると透析や腎移植が必要となる深刻な疾患。効果的な治療法開発のためには、CKDの発症メカニズムや病態進行の過程を詳しく解明することが不可欠だ。動物モデルは疾患研究において非常に重要なツールだが、従来のモデルには限界があった。特に、胎仔期から発症する腎不全のモデルを作製することは技術的に困難であり、研究の大きな障壁となっていた。また、近年注目されている異種移植・再生医療領域においても、拒絶反応の問題を克服し、機能的な臓器を効率的に作製する技術が求められている。
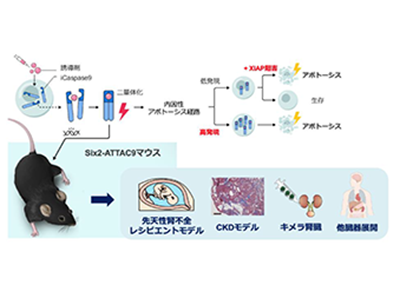
Six2陽性ネフロン前駆細胞選択的にアポトーシス誘導できるSix2-ATTAC9マウスを開発
研究グループは、これまでの課題を克服するため、細胞死を人工的に誘導するシステムである「誘導性Caspase9(iCaspase9)」に着目した。そして、iCaspase9を動物に組み込んだモデルとして、通称「ATTAC9(アタックナイン):Apoptosis Through Targeted Activation of Caspase9」を作製し提案している。同技術はプログラムされた細胞死の一種であるアポトーシスにおいて、内因性アポトーシス経路の主要な実行因子であるCaspase9に着目し、人工的に作製された誘導剤と結合するiCaspase9を細胞に組み込むことで、誘導剤の投与に応じてアポトーシス経路を活性化し、標的細胞を迅速かつ効率的に除去することを可能にする。
今回、研究グループはiCaspase9をマウスに応用したSix2-ATTAC9マウスを開発した。腎臓の元となるSix2陽性ネフロン前駆細胞を選択的にアポトーシス誘導することに成功し、ATTAC9システムが胎仔臓器への細胞除去性能に優れていることを明らかにした。その結果、いくつかの成果が得られた。
母体への誘導剤投与で胎仔のネフロン前駆細胞を減少、腎不全発症に成功
開発したATTAC9モデルは従来の細胞除去手法と比較して、細胞除去速度、除去効率、安全性において優位性を示し、胎仔および母体への負担を大幅に軽減した。妊娠中の母体に誘導剤を投与することで、胎仔のネフロン前駆細胞を迅速かつ高効率に減少させ、腎不全を発症させることに世界で初めて成功した。研究グループは、近年進展する異種移植研究において、世界に先駆けて先天性腎不全の胎児を対象とした異種胎仔腎移植による治療法を提唱している。同モデルはその研究のためのレシピエントモデルとしての活用可能性も秘めている。
腎不全の重症度の調整が可能・妊娠13.5日目に投与した胎仔は出生後も生存
さらに、糸球体過剰濾過モデルの確立とCKD病態の再現にも成功した。妊娠時期が進むにつれて臓器発生が進み、ネフロン前駆細胞は成熟腎細胞に分化していくため、誘導剤の投与時期を遅らせることで腎不全は軽度となるが、同システムの効率性・迅速性という利点を生かし、投与時期の調整のみによって、再現性高く腎不全の重症度を調整することが可能となった。
特に妊娠13.5日目に投与した胎仔は出生後も生存可能であり、慢性的な腎機能障害を詳細に観察することができた。このマウスはヒトのCKD患者と同様に、糸球体の腫大や硬化、間質の線維化、炎症細胞の浸潤といった特徴を示した。これは残された腎機能で老廃物を濾過しようとする糸球体過剰濾過という病態を再現していることを示唆しており、CKDの進行メカニズム解明に非常に有用なモデルとなることが期待される。
ヒト腎組織を組み込んだキメラ腎臓の作製にも成功
また、Six2-ATTAC9マウスの胎仔腎臓からネフロン前駆細胞を除去し、ヒトiPS細胞由来の前駆細胞を注入することで、ヒト腎組織を組み込んだキメラ腎臓の作製に成功した。このキメラ腎臓はマウス生体内での成熟も示した。キメラ腎臓は、異種臓器において同種であるヒトの成分を増やすことで拒絶反応を低減することが期待されており、異種移植と再生医療の融合として新たな可能性をもたらす。
CKDや先天性腎不全に苦しむ患者たちの福音となることに期待
今回の研究により、iCaspase9の発現量がアポトーシス誘導に重要であること、また固形臓器は細胞がばらばらになった状態と比較してアポトーシスに抵抗性を示すことが動物モデルを用いて初めて明らかにされた。さらに、iCaspase9発現量が少ない場合やアポトーシス抵抗性が高い状態であっても、アポトーシス阻害作用を持つXIAPの阻害剤を併用することでアポトーシスが誘導可能となることも判明した。この発見は、これまでiCaspase9を持つ動物モデルが成功していなかった理由の一部を説明する可能性があり、同システムの応用範囲を拡大する上で重要な知見となると考えられる。
同成果はCKD研究・異種移植・再生医療研究といった広範な分野にブレークスルーをもたらす可能性を秘めている。さらに、人工的アポトーシス誘導は細胞除去に伴う周囲の炎症反応が少ないという特徴から、老化細胞除去による疾患治療や健康寿命の延伸を目指す老化研究においても、ATTAC9モデルのようなアポトーシス誘導技術が有用なツールとなることが期待される。今後は、ATTAC9モデルを基盤として「CKDの進行を抑制する新たな治療法の開発」「糸球体過剰濾過のメカニズム解明」「先天性腎不全(ポッター症候群など)に対する新規治療戦略の開発」「移植可能なキメラ腎臓作製技術の確立」「ATTAC9モデルの応用範囲拡大に向けた研究」などを重点的に推進し、研究を飛躍的に発展させていく予定だとしている。
「本研究成果が、CKDや先天性腎不全に苦しむ患者の福音となり、異種移植・再生医療による臓器移植医療の発展、ひいては健康長寿社会の実現に貢献できるよう、研究チーム一同、総力を結集し邁進していく」と、研究グループは述べている。
▼関連リンク
・慈恵大学 プレスリリース



