THAP1を原因とするジストニア、具体的な発症機構は未解明
東京大学は2月17日、神経疾患ジストニアの原因遺伝子THAP1が、細胞内のタンパク質分解システムを制御していることを明らかにしたと発表した。この研究は、同大大学院薬学系研究科の王研大学院生(研究当時)、王漪大学院生、濱崎純講師、村田茂穂教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ジストニアは、若年発症が多く、筋肉の異常な収縮や動きの制御障害を引き起こす神経疾患であり、日常生活に大きな影響を与える。その原因の1つとして、THAP1遺伝子の機能喪失型変異が知られているが、明確な病理的特徴や具体的な発症メカニズムはこれまで不明だった。
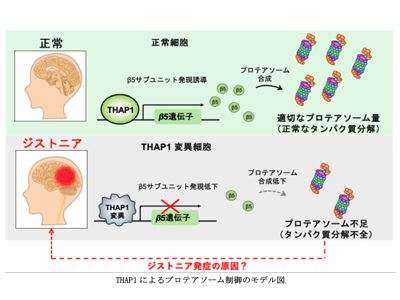
THAP1、プロテアソームの中核的酵素サブユニットβ5を発現制御すると判明
今回、研究グループは、THAP1が細胞内の中心的なタンパク質分解システムに必須の役割を果たしていることを見出した。
細胞は、不要になったり、損傷したりしたタンパク質を適切なタイミングで分解して処理するシステムを備えており、この分解を担うのがプロテアソームである。プロテアソームは多くのサブユニットから構成され、細胞内のタンパク質分解において中心的な役割を果たしている。今回の研究では、THAP1がプロテアソームの中核的な酵素サブユニットであるβ5(PSMB5)の発現を直接制御していることを明らかにした。β5はプロテアソームの主要な分解活性を担うサブユニットであり、その不足はプロテアソームの形成不全に基づく機能低下を引き起こす。
THAP1変異によるプロテアソーム機能低下、マウス実験でも確認
研究グループは、THAP1遺伝子を欠損させた細胞で、プロテアソームの組み立てが不完全になり、細胞内に分解されるべきタンパク質が蓄積することを確認した。この異常は、神経細胞の機能不全を引き起こし、ジストニアのような神経疾患の原因になる可能性がある。また、遺伝子改変マウスを用いた実験でも、ジストニア患者で見られるTHAP1遺伝子の変異が、プロテアソームの機能低下を引き起こすことが確認された。
PSMB5の過剰発現、THAP1欠損によるプロテアソーム活性低下を回復
さらに、PSMB5の過剰発現により、THAP1欠損によるプロテアソーム活性の低下を回復できることも明らかになった。このことから、β5(PSMB5)の発現量がプロテアソームの機能を左右する重要な要素であることが示され、THAP1がその制御において中心的な役割を果たしていることが示唆された。
今回の研究は、ジストニアなどの運動障害を伴う神経疾患におけるプロテアソーム機能不全が重要な病因である可能性を示す重要な成果である。「今後、この分解システムを標的とした新たな治療法の開発が期待される。また、認知障害を伴う他の神経疾患における共通のメカニズム解明にも貢献する可能性がある」と、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース



