レビー小体形成の分子的背景に関与する「シード」、性質や産生メカニズムは未解明
京都府立医科大学は2月7日、パーキンソン病(PD)脳内における神経変性拡大の分子メカニズムを解明したと発表した。この研究は、同大大学院医学研究科生体構造科学の田口勝敏講師、田中雅樹教授、大学院医学研究科基礎老化学の渡邊義久講師らの研究グループによるもの。研究成果は、「iScience」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
αシヌクレイン(α-Synuclein:αSyn)はPDやレビー小体型認知症(DLB)に特徴的な細胞内凝集体「レビー小体」の主要構成タンパク質であり、その遺伝子の変異や重複が家族性PDを引き起こすことから、PDやDLBといったレビー小体病の発症に関わる重要な分子と位置付けられている。
レビー小体の形成領域はPDの最初期には嗅球や延髄において観察され、病期の進行に伴い下部脳幹から大脳皮質に向かって上行性に拡大することが多くの病理学的研究によって報告されている。現在、この脳内変性領域拡大の分子的基盤として「プリオン様細胞間伝播」の存在が指摘されている。高分子化したαSynが神経細胞内へ取り込まれると重合核となり、細胞内に発現するαSynがさらに重合を開始し、最終的にはレビー小体の形成につながると考えられている。以上のことから、この重合核は「シード」と呼ばれている。
これまでの研究により、培養神経細胞やマウス脳内において、レビー小体様凝集体の形成を再現できることが報告されている。しかしながら、人工的に一次病的モデル神経細胞を作製することはできたとしても、生きた病的神経細胞が自ら産生し、細胞外に分泌した細胞間伝播性シードの性質や細胞内でシードが産生されるメカニズムについては現在も不明な点が数多く残されている。
レビー小体様凝集体有するモデル細胞から産生されたシードを分離、大量回収にも成功
研究グループは今回、初代培養神経細胞を用いてレビー小体様凝集体を有するモデル細胞を作製し、この病的神経細胞が自ら産生・分泌したシード分子を分離・回収することに成功した。また、細胞から細胞へと伝播する分子の実像を電子顕微鏡で観察することに成功した。この分離プロセスでは、特殊な培養システム「マイクロ流路デバイス」を使用した。しかしながら、市販されているマイクロ流路デバイスはサイズが小さいため、少量のシード分子の回収は可能だが、生化学的な解析を推し進めるためには大量のシードを回収することができるデバイスの開発が必要となった。研究グループでは、大量にシードを回収することを目的に大型のマイクロ流路デバイスを独自に開発した。このデバイスの開発により、効率よく大量のシードを分離・回収することができた。
シードを構成するαSynのN末端、酵素「SENP2」により切断されると判明
大型のマイクロ流路デバイスにより大量に回収したシードを用いて、シードを構成するαSynの分子修飾を質量分析法により解析した。その結果、シードに含まれる一部のαSynのN末端が切断されていることを見出した。興味深いことに、切断は繰り返し配列に含まれるアミノ酸「リジン」のN末側で切断を受けていることがわかった。この情報を基に、切断に関わる酵素を検索し、試験管内においてαSynを当該配列で切断する酵素「SENP2」を見出した。
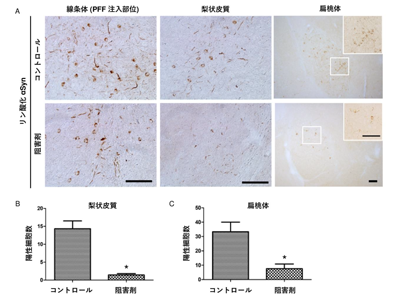
レビー小体様凝集体再現マウス、SENP2阻害剤の側脳室内徐放でシードの細胞間伝播が抑制
最後にSENP2の酵素活性がαSynの凝集形成能やシードの細胞間伝播にどのような影響を与えるのかを明らかにするため、マウスを用いたレビー小体様凝集体再現モデルによる組織学的検討を行った。浸透圧ポンプによりSENP2阻害剤を側脳室内に徐放させると、効果的にシードの細胞間伝播を抑制できることがわかった。今回の研究では、SENP2によってαSynが切断されると、αSynの凝集能が上昇することも見出している。
以上の結果から、神経細胞内に発現するαSynがSENP2により切断されることによって、シードの形成および脳内におけるプリオン様細胞間伝播を促進することが推察される。
SENP2阻害化合物のスクリーニングなど、創薬につながる研究展開に期待
今回の研究により、レビー小体病における神経変性領域拡大の分子メカニズムの一端を解明することができた。今後は新しい標的分子であるSENP2の酵素活性を抑制することによって、より効果的に神経保護を図る新しいストラテジーの構築が望まれる。「選択性が高く、さらに効果的なSENP2阻害化合物のスクリーニングやシード分子を抗原とした立体構造特異的なモノクローナル抗体によるシードの細胞間伝播抑止など、創薬に結実する研究の展開が期待される」と、研究グループは述べている。
▼関連リンク
・京都府立医科大学 新着ニュース




