過敏性腸症候群の治療は対症療法しかないため、患者の治療満足度が低い
東京理科大学は2月13日、過敏性腸症候群(IBS)に対し、画期的なメカニズムで作用する新薬の可能性を明らかにしたと発表した。この研究は、同大薬学部 薬学科の斎藤顕宜教授、同・薬学研究科 薬学専攻の吉岡寿倫氏(博士課程3年)らの研究グループによるもの。研究成果は、「British Journal of Pharmacology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
過敏性腸症候群は、全世界の有病率が10%程度と非常に高く、代表的なストレス関連疾患だ。腸に器質的な異常がないにもかかわらず、下痢・便秘・腹痛、またはそれらが複合して起こるのが特徴で、患者のQOLに深く影響している。しかし、その原因やメカニズムは明らかになっておらず、治療薬は下痢止めや便秘薬、鎮痛薬などの対症療法に限られている。そのため治療満足度が低く、対症療法ではない治療薬が求められている。
過敏性腸症候群は心理的なストレスにより腸の異常な動きが起こると考えられている。実際に、過敏性腸症候群患者は、うつ病など何らかの精神疾患を併発していることが多いことがわかっている。
「δ受容体作動薬」が過敏性腸症候群の治療薬になるのか検証
研究グループはこれまで、既存薬とは異なるメカニズムを持つ向精神薬としてオピオイドδ受容体作動薬に着目し、研究を進めてきた。オピオイドδ受容体作動薬の特徴としては、抗ストレス作用を持ち、副作用が少ないことが挙げられる。また、オピオイドδ受容体作動薬が脳のどの部分に、どのように作用するのかの解明も進めている。以前にも分子メカニズムを明らかにし、既存薬では治療困難なうつ病患者にも一定の効果が期待できるという研究結果を発表している。
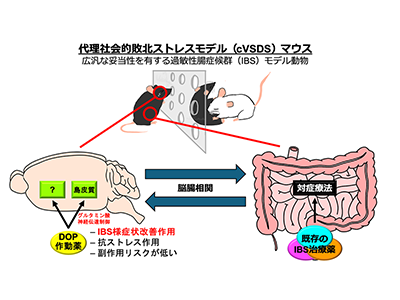
今回研究グループは、オピオイドδ受容体が脳の中枢神経系にある「島皮質」と呼ばれる部位に豊富にあることに着目した。この部位は脳の中でも内臓機能を調節する高次な中枢神経系であり、ここにオピオイドδ受容体作動薬が作用することで、対症療法ではない過敏性腸症候群の治療薬になるのではないかと考え、研究を行った。
下痢型の過敏性腸症候群マウスに、オピオイドδ受容体作動薬を3種の方法で投与
まず、慢性的な「代理社会的敗北ストレス(cVSDS、他のマウスが身体的攻撃を受けている様子を見せることで、与える心理的なストレス)」のモデルマウスを準備した。他のマウスへの攻撃を目撃させるストレスを与えたマウスはうつ病のモデルとなる。
このマウスに墨液を経口投与し、その腸管の移動距離から腸のぜん動運動の程度を評価した。また、少量のカプサイシンを直腸内に投与したときのマウスの反応から、腸管の痛覚過敏性を評価した。腸管の痛覚過敏性は、過敏性腸症候群の症状である慢性的な腹痛の指標になる。さらに、脳の島皮質での細胞外のグルタミン酸も測定できるように準備した。
下痢型の過敏性腸症候群となったマウスに、オピオイドδ受容体作動薬の薬剤を「全身投与(皮下注射)」「脳内への投与(脳室内投与)」「島皮質への直接投与」の3種類の方法で行った。
オピオイドδ受容体作動薬の全身投与で過敏性腸症候群の症状が抑制
その結果、オピオイドδ受容体作動薬の全身投与により、腸のぜん動運動の活発化は調整され、カプサイシン投与での腸管痛覚過敏に関連した行動も減少したことが確認された。オピオイドδ受容体作動薬の脳内への投与や島皮質への直接投与でも、これと同じような結果が得られた。
オピオイドδ受容体作動薬が島皮質での作用を通じて症状が緩和した可能性
過敏性腸症候群となったマウスの島皮質でのグルタミン酸濃度を測定したところ、ストレスが高くなると島皮質におけるグルタミン酸の伝達反応性は高まり、下痢の症状を引き起こした。オピオイドδ受容体作動薬を投与するとグルタミン酸の伝達は抑制され、下痢の症状はおさまった。これらはオピオイドδ受容体作動薬が島皮質での作用を通じて症状が緩和したことを示唆している。これにより、脳の島皮質と腸のぜん動運動との関係(脳腸相関)に対するオピオイドδ受容体の関与も示唆された。
現在の過敏性腸症候群の治療は対症療法に限られることから患者の満足度が低いため、同研究結果は将来の過敏性腸症候群の治療戦略にとって重要な意義を持っている。
オピオイドδ受容体が、過敏性腸症候群の新規治療法の有望なターゲットに
今回の研究では、オピオイドδ受容体作動薬が、マウスにおけるストレス誘発性の過敏性腸症候群(下痢型)の症状を改善することを示した。これらの結果から、オピオイドδ受容体は、過敏性腸症候群の新しい治療法の有望なターゲットと考えられる。
「心理的なストレス、身体的や社会的な痛み、内臓の機能制御、自律神経系などと関わりがある島皮質は、現在研究が進んでいるがまだ明らかでないことも多い部位だ。本研究結果は、その詳細なメカニズムの解明にも寄与すると考えられる。また、さらなる研究を通じ、脳が内臓機能をどのように調節しているのか、詳細なメカニズムの解明にも期待が持たれる」と、研究グループは述べている。
▼関連リンク
・東京理科大学 プレスリリース



