ほとんどのがん化学療法剤において、効果予測するバイオマーカーは未確立
愛媛大学は2月5日、がん化学療法の効果を高める重要なタンパク質「SLFN11(シュラーフェンイレブン)」の働きを明らかにしたと発表した。この研究は、同大プロテオサイエンスセンターの村井純子准教授、慶應義塾大学先端生命科学研究所ほかの研究グループによるもの。研究成果は、「Molecular Cell」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん化学療法は、がん治療の根幹であり、多くの患者にとって生命を延ばすための重要な手段となっている。しかし、化学療法の効果は患者ごとに差があり、また副作用はしばしば深刻で、患者の生活の質を大きく損なう可能性がある。そのため、治療の恩恵を最大限受けられる患者と、そうでない患者を正確に見極めることができれば、より個別化された治療が実現し、副作用を最小限に抑えた適切な治療法の選択が可能になる。
治療の効果予測には「バイオマーカー」(生物学的指標)が重要な役割を果たす。例えば、乳がん治療においては、がん細胞に含まれるホルモン受容体の量を調べることで、ホルモン剤を投与するかどうかを判断する。このように、バイオマーカーを活用できる治療薬もあるが、ほとんどの化学療法剤に関して、現時点ではその効果を予測するためのバイオマーカーは確立されていない。
DNA障害型抗がん剤バイオマーカー候補「SLFN11」、発現制御や作用機構の詳細は未解明
2012年、SLFN11(Schlafen 11)という遺伝子の発現量が、がん化学療法における効果予測バイオマーカーの有力な候補として浮上した。これまでに、SLFN11の発現量と、化学療法の主軸であるDNA障害型抗がん剤の感受性との因果関係が多くの研究で証明されている。また、臨床研究では、卵巣がん、肺がん、膀胱がん、胃がん、頭頸部がん、食道がん、乳がんなど、多くのがん種において、SLFN11が高発現している場合、DNA障害型抗がん剤を含む化学療法の効果が高く、生命予後も良好であることが示されている。これらのことから、がん細胞におけるSLFN11の発現量を調べることで、DNA障害型抗がん剤の効果を予測することが可能となると考えられる。
多くの場合、遺伝子の変異がバイオマーカーとして利用されるが、SLFN11遺伝子に変異が見つかることはほとんどなく、SLFN11については発現量が薬剤効果のバイオマーカーとして重要となる。SLFN11の臨床応用に向けての研究が進む一方で、SLFN11遺伝子研究の歴史がまだ浅いことから、発現制御の仕組みやその具体的な作用メカニズムについては未解明の部分が多く残されている。
SLFN11、DNA障害型抗がん剤投与によりrRNA合成低下させ著しくタンパク質合成低下
このような背景のもと、研究グループは今回、新たにSLFN11がリボゾームRNA(rRNA)の転写を抑制することで、DNA障害型抗がん剤の効果を高めるメカニズムを発見した。
rRNAは、タンパク質合成の場であるリボゾームの構成要素であり、全ての細胞にとってその合成は不可欠である。特に、がん細胞では急速な増殖に伴いタンパク質合成が非常に活発であり、その結果、rRNAの合成も盛んに行われている。rRNAの合成は細胞核内の核小体で行われるため、この過程を標的とした研究はこれまでも活発に行われてきた。
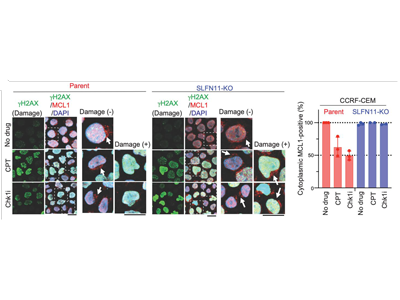
今回の研究では、DNA障害型抗がん剤の投与により、SLFN11が核小体におけるrRNA合成を低下させることを発見した。この結果、リボゾームの機能に異常が生じ、タンパク質合成が著しく低下することが判明した。
薬剤投与<SLFN11<リボソーム機能障害<MCL1劇減<アポトーシス誘導
特に、半減期が短いタンパク質は、SLFN11の機能が発揮されてからわずか4~6時間以内にタンパク質レベルが劇的に減少した。これらの激減するタンパク質の中には、ミトコンドリア周囲でアポトーシスを抑制しているMCL1タンパク質が含まれていた。その他、さまざまな検証の結果、薬剤投与によってSLFN11が機能すると、リボゾーム機能の障害が起こり、タンパク質合成(翻訳)が低下し、MCL1の劇的な減少がアポトーシスを誘導するという、新たな経路が明らかになった。
既報告とは異なる新たなアポトーシス誘導経路発見、少なくとも3つの経路でがん細胞を攻撃
研究グループは2018年に、SLFN11がDNA複製をブロックすることによってDNA障害型抗がん剤の効果を高めるメカニズムを発見した。この研究は、SLFN11がDNA複製の過程を直接的に抑制することでがん細胞の増殖を制御し、抗がん剤の効果を向上させることを示した初めての成果だった。2024年には欧州の研究グループがScience誌において、SLFN11がアポトーシスに関わるJNKシグナル経路を活性化することでアポトーシスを誘導するという新たなメカニズムを報告した。
一方で、今回の研究で発見したSLFN11がDNA障害型抗がん剤の効果を高めるメカニズムは、2024年報告されたJNKシグナル経路を活性化するメカニズムとは異なる経路であることが確認された。また、本メカニズムは、がん細胞の約7割で細胞死を引き起こしたが、残りの約3割の細胞では即時的なアポトーシスが見られなかった。しかし、その場合でもSLFN11が発現している限り、SLFN11によるDNA複製の停止メカニズムが作用し、24~48時間以内にSLFN11依存的な細胞死が誘導されることが確認された。この知見は、研究グループが2018年に報告したSLFN11によるDNA複製停止メカニズムを補強するものである。これらのことから、SLFN11は少なくとも3つの経路でがん細胞を殺していることがわかった。
SLFN11を活用したがん治療に期待、広範ながんに対して応用可能で検査も簡便
がん種によって差はあるものの、SLFN11の発現は全体の約半数のがん細胞で上昇していることが報告されており、DNA障害型抗がん剤を含む化学療法の効果予測バイオマーカーとして非常に有望である。今回の研究では、SLFN11による新たなアポトーシス誘導メカニズムを報告した。今回示されたSLFN11を介したアポトーシス誘導は、がん抑制遺伝子TP53(p53)の機能に依存しないことも明らかにした。TP53の機能不全はがん細胞の特徴の1つであり、アポトーシス誘導を難しくする要因とされているが、SLFN11によるアポトーシス経路はこの制約をほとんど受けない。この点で、今回の研究は、TP53機能不全を有するがん細胞を含む、広範ながんに対して応用可能と考えられる。
SLFN11が約半数のがんで発現が上昇している事実は、SLFN11を効果予測バイオマーカーとして利用する上で非常に理想的である。一方で、SLFN11が抗がん剤の効果を高めるために進化したとは考えにくい。ヒトはSLFN11以外にもSLFN、SLFN12、SLFN13、SLFN14を持っているが、それらに共通する機能としてtRNAの切断があり、これは抗ウイルス作用に関与していると考えられている。その中で、研究者たちはSLFN11をがん治療に応用できることを発見した。SLFN11は霊長類と一部の哺乳類にしか見つかっていない。
2019年から日本ではがんゲノムパネル検査が保険適用となったため、個人のがんゲノム解析の結果を基に治療薬を選択すること(プレシジョンメディシン:精密医療)が可能となっている。一方で、この検査は、患者にとって一度しか受けられない、検査費用が高額であるといった制限や、治療薬が見つかる割合が10%程度で頭打ちになっているという問題点がある。また、多くのがん患者が投与されるDNA障害型抗がん剤はそもそも、検査結果に紐づく薬剤(コンパニオン診断薬)には含まれていない。プレシジョンメディシンをDNA障害型抗がん剤に応用するためには、現状を打破する必要がある。
SLFN11の発現検査は、臨床現場で広く用いられている病理検査(免疫組織検査)で簡便に行うことができ、検査費用も比較的安価なため、汎用性が期待できる。さらに、将来的には血液循環がん細胞(がん組織から剥がれて血液を流れる腫瘍細胞)を用いることで、複数回の解析やがんの進行に応じた柔軟な治療選択が可能となると考えられる。SLFN11は、2012年以降、研究報告数は増加傾向にあるものの、これまでに発表された論文は約200報とまだまだ少なく、研究者数も限られている。今回の研究の成果は、DNA障害型抗がん剤の効果予測バイオマーカーとしてのSLFN11の重要性を医療関係者や一般社会に向けてアピールする上で、非常に意義深いものである。「今後、SLFN11を活用したがん治療が実現すれば、より多くのがん患者に対して、最適な治療法を提供できるようになり、がん医療の未来に大きな革新をもたらすことが期待できる」と、研究グループは述べている。
▼関連リンク
・愛媛大学 プレスリリース



