脳内炎症の制御、AD進行抑止の重要な治療標的として注目
国立長寿医療研究センター研究所は1月22日、アルツハイマー病モデルマウスを用いた研究から、アミロイド斑の蓄積が引き起こす認知機能の低下や神経細胞死に深く関わると考えられている「脳内の慢性炎症」を反映して血液中で変化する代謝物を同定し、新たな血液バイオマーカーや治療標的としての可能性を見出したと発表した。この研究は、同研究所認知症先進医療開発センター・神経遺伝学研究部の関谷倫子副部長、飯島浩一部長らの研究グループによるもの。研究成果は、「Neurobiology of Disease」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
認知症の最大の原因であるアルツハイマー病は、患者数の急速な増加が見込まれることから、その予防・治療法の確立は喫緊の課題とされている。脳内へのアミロイド斑の蓄積が、シナプスの変性、タウ病理の拡大、そして神経細胞の脱落を引き起こし、発症に至ると考えられている。この一連のメカニズムには、ミクログリアやアストロサイトと呼ばれるグリア細胞が、アミロイド斑を異物として認識して活性化した状態が続く「脳内の慢性炎症」が深く関わっていると考えられている。実際、脳内の炎症状態と認知機能の低下がよく相関するという報告もあり、グリア細胞を標的とした脳内炎症の制御は、アルツハイマー病の進行を抑止する重要な治療標的として注目されている。
なかでもアストロサイトは、健康な脳では神経細胞への栄養補給や血液脳関門の制御、またシナプスの形成など、脳の高次機能や恒常性の維持に欠かせない働きをしている。しかしアルツハイマー病の脳では、アストロサイトはアミロイド斑に反応して慢性的に活性化しており、アストロサイトが本来担う脳の恒常性を保つ働きができなくなった結果、神経機能の低下や神経細胞死が起こっている可能性がある。従って、アストロサイトの活性化を反映する血液バイオマーカーや、その活性を制御するメカニズムの解明は、アルツハイマー病の画期的な診断法や治療法の開発につながると考えられる。
モデルマウスでNAD+代謝酵素として知られるCD38タンパク質量が増加していることを発見
研究グループは、アミロイド斑の蓄積に伴う脳内炎症を反映する血液バイオマーカーを探索するために、キャピラリー電気泳動-飛行時間型質量分析計(CE-TOFMS)法を用いて、アミロイド病理と脳内炎症を再現するアルツハイマー病モデルマウスの血液(血漿)中のメタボローム解析を行った。
その結果、モデルマウスの血漿中で、水溶性ビタミンB群の一つであるニコチンアミド(ナイアシン)が顕著に減少していることを見出した。ニコチンアミドはニコチンアミドアデニンジヌクレオチド(NAD+)の原料で、パスウェイ解析からも血漿中の代謝物の変動がNAD+代謝経路に集積することを見出した。NAD+は細胞のエネルギー代謝や修復、炎症反応、神経保護作用など多岐に渡る機能を担い、NAD+量の低下は老化の促進や、疾患の進行に関わることが報告されている。
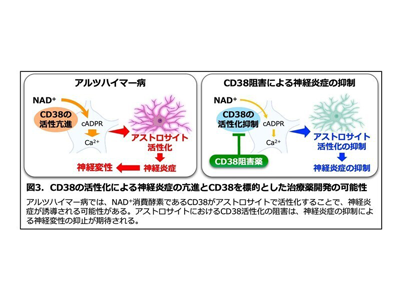
次に、アルツハイマー病モデルマウスの血漿中でニコチンアミドが減少していた理由を探るために、脳におけるNAD+代謝経路の変化を調べた。その結果、生体内の主要なNAD+消費酵素として知られるCD38(cluster of differentiation 38)タンパク質の量が、アルツハイマー病モデルマウスの脳で顕著に増加していることを見出した。
CD38発現<アストロサイト活性化<NAD+代謝亢進<血中ニコチンアミド量低下を示唆
さらに免疫組織学的解析から、CD38はアルツハイマー病モデルマウスの脳内では、アミロイド斑を取り囲むアストロサイトで強く発現していることも見出した。CD38は、NAD+を分解して、セカンドメッセンジャーであるADPR(adenosine diphosphate ribose)やcADPR(cyclic ADPR)を産生し、細胞内カルシウム濃度を上昇させて末梢の免疫細胞の活性化や、中枢のアストロサイトの活性化に関わることが報告されている。
これらの結果から、アルツハイマー病モデルマウスの脳内では、アミロイド斑に対するアストロサイトの活性化によりNAD+代謝が亢進し、血液中のニコチンアミド量が低下した可能性が考えられた。
血中ニコチンアミド量の低下がバイオマーカーになる可能性
今回の研究から、血液中のニコチンアミド量の低下は、アミロイド斑に対してアストロサイトが活性化し、脳内炎症が亢進した状態を検出する新たな血液バイオマーカーになる可能性が示された。「さらにCD38によるNAD+分解活性の阻害は、アストロサイトの活性化による脳内炎症を抑制することに加えて、神経保護効果を持つNAD+量を脳内で上昇させることからも、アルツハイマー病の新たな治療薬の開発につながる可能性がある」と、研究グループは述べている。
▼関連リンク
・国立長寿医療研究センター研究所 プレスリリース



