CAR-T細胞療法、重大な副作用「サイトカイン症候群」が課題
東京医科大学は12月26日、T細胞補助刺激受容体である2B4(CD244、SLAMF4)の超解像イメージングを通して、2B4シグナル伝達のスイッチング機構によるTリンパ球(T細胞)調節機構を明らかにし、その特徴を応用した炎症性サイトカインの産生を抑えたキメラ抗原受容体(CAR)の基盤モデルを確立したと発表した。この研究は、同大免疫学分野の横須賀忠主任教授、熊本大学大学院医学教育部博士課程の松島遼平大学院生(当時)、生命科学研究部呼吸器外科・乳腺外科学の鈴木実教授らの研究グループによるもの。研究成果は、「iScience」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん免疫療法において、免疫チェックポイント分子阻害(ICI)療法に続く、第2のブレイクスルーとして、「キメラ抗原受容体(CAR)導入T細胞療法」が近年、大きな注目を浴びている。CAR-T細胞療法は、これまでがん免疫療法として長く行われてきた「養子免疫療法」の1つで、患者から採取したT細胞に、がん抗原を認識する抗体とT細胞受容体を部分的につなぎ合わせた人工の受容体CAR(chimeric antigen receptor)を遺伝子導入して体に戻すことで、劇的な効果が得られる治療法である。日本でも、チサゲンレクルユーセル(キムリア(R))やアキシカブタゲン シロルユーセル(イエスカルタ(R))が知られている。オーダーメイド治療のため非常に高額で、日本国内でも限られた施設でしか行うことができないが、通常のがん治療では治らなかった悪性リンパ腫や白血病の一部の症例で確かな治療効果が認められている。また最近は悪性黒色腫などの固形腫瘍に対する適応も検討され始めており、新たな腫瘍をターゲットにしたCAR-T細胞の開発が年々加速している。
一方、重大な事象として、CAR-T細胞による脳炎や、活性化したCAR-T細胞が放出する過剰な炎症性サイトカインが引き起こす「サイトカイン症候群」が知られている。サイトカイン症候群は、新型コロナウイルス感染症の重症化とも大きく関連していた。CAR-T細胞療法でも新型コロナウイルス感染症でも、一度起こしたサイトカイン症候群の治療には、抗IL-6受容体抗体(Tocilizumab、アクテムラ)を用いた対症療法しかなかった。
T細胞の活性化・抑制化の二相性に働く補助刺激受容体、「2B4」に着目
今回、研究グループはT細胞の補助刺激受容体2B4の機能を応用した新しいCARのモデルを検証した。2B4は、条件の違いでT細胞の活性化と抑制化の両方「二相性」に働くスイッチング受容体であることが知られている。しかし、二相性として働く詳しいメカニズムはいまだ解明されていなかった。そこで、研究グループがこれまで意欲的に行ってきた、がん細胞の細胞膜を模倣した人工平面脂質膜(SLB)と超解像顕微鏡を用いた独創的かつ先端的な1分子1細胞イメージングを用いて、CARへの応用も見据えた、2B4機能の分子メカニズムの解明に取り組んだ。
人工平面脂質二重膜に形成の2B4クラスター、SHIP-1呼び寄せT細胞サイトカイン産生を抑制
今回、2B4のリガンドであるCD48を組み入れた「人工平面脂質二重膜」を新たに作成し、2B4を発現しているT細胞を二重膜の上にのせ、2B4の挙動を1分子レベルでイメージング解析した。T細胞は数分をかけて脂質二重膜に接着し、その接着面には、CD48との結合を機に2B4分子が数十個集まったクラスターが連続的に形成される様子が観察された。
2B4のクラスターは、抗原ペプチドが結合した主要組織適合性複合体(pMHC)との結合を機にできるTCRの凝集「TCRマイクロクラスター」と同じ位置に形成され、さらに脂質脱リン酸化反応を担う酵素(フォスファターゼ)SHIP-1を呼び寄せることがわかった。この抑制性シグナルの挙動がT細胞の機能にどう影響を与えているのか実験したところ、T細胞ががん細胞を攻撃する細胞障害活性には差は見られなかった一方、T細胞からのサイトカイン産生が抑制されることがわかった。
アダプター分子SAPが2B4に結合すると、SHIP-1が集積されずサイトカイン産生増加
続いて、2B4のアダプター分子であるSAPを2B4と同時にT細胞に発現させてイメージング解析を行った。その結果、2B4マイクロクラスターと同じ位置でSAPはクラスターを作り、さらに、チロシンリン酸化酵素であるFynも同様にクラスターを形成するようになった。一方で、先ほど集積が見られたSHIP-1の集積が見られなくなることがわかった。つまり、SAPが2B4に結合すると、1)FynがSAPを介して2B4にリクルートされる、2)SHIP-1が2B4に集積できなくなる、ことで活性化のシグナル複合体を形成するようになることが確認された。この結果、サイトカイン産生が増えることもわかった。
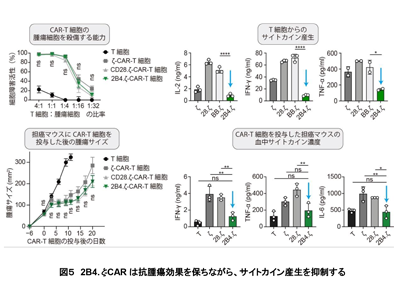
2B4.ζ-CAR作製、既存3種CARと比較し抗腫瘍効果変わらずサイトカイン産生少ないと判明
これらの2B4の二相性の特徴をCAR-T細胞療法に生かすことができないかと考え、CARの共刺激ドメインに2B4とCD3ζを組み込んだ、2B4.ζ-CARを新しく作製した。2B4.ζ-CARを発現させた2B4.ζ-CAR-T細胞は、その標的分子であるCD19と結合すると、CARマイクロクラスターを形成した。2B4.ζ-CARマイクロクラスターの下流では、先ほどの2B4のイメージング解析で見られたシグナル伝達機構が同様に働くことが確認された。
続いて既存の3種類のCAR(ζ-CAR、CD28.ζ-CAR、4-1BB.ζ-CAR)と比較して、2B4.ζ-CAR-T細胞の機能解析を行ったところ、予想通り、抗腫瘍効果は変わらない一方で、他種類のCARよりもサイトカイン産生量が少なくなっていることがわかった。この結果は、実際にマウスにCAR-T療法を行ったin vivoの実験においても同様であることを研究グループは確認した。これらの結果から、2B4.ζ-CARはCAR-T細胞療法の重大な副作用であるサイトカイン症候群を回避できる可能性があると考えられた。
副作用が懸念される場合のCAR-T療法において、治療選択肢を広げると期待
2B4は、がん免疫だけでなく自己免疫など幅広い場面において、T細胞の機能調節を担っており、それらの疾患との関連性が示唆されている。生理学的、総論的に2B4がT細胞においてどのような仕組みでどのような機能を果たしているのか、分子の特徴を知ることは、各疾患における病態の解明、さらに治療法の開発において非常に重要であると考えられる。さらに理解を深め、実臨床に直結させるために、今後はヒトの細胞を用いた研究につなげていくことが必要とされる。
また、今回研究した2B4.ζ-CARは、現在保険適用となっている4-1BB.ζ-CARやCD28.ζ-CARなどに加えた、新たなCARの候補になりうることが示唆された。例えば、高齢患者や基礎疾患の多い患者など副作用が懸念されるケースに対するCAR-T療法の治療選択肢を広げることが期待される。「また、今後の研究展開として、2B4の二相性の特徴を利用し、2B4.ζ-CAR-T細胞にSAPを誘導的に発現させることで、抗腫瘍効果やサイトカイン産生をコントロールできるCARの創造も期待される」と、研究グループは述べている。
▼関連リンク
・東京医科大学 プレスリリース



