EBウイルスの持続的感染により発症する難治性リンパ腫ENKTCL、詳細な病態は未解明
国立がん研究センターは11月28日、NK(ナチュラルキラー)細胞リンパ腫の新規マウスモデルを開発し、その発症メカニズムを解明したと発表した。この研究は、同センター研究所分子腫瘍学分野の古屋淳史外来研究員(慶應義塾大学医学部内科学教室(血液)専任講師)、片岡圭亮分野長(慶應義塾大学医学部内科学教室(血液)教授)らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
リンパ腫は血液がんの1つで、白血球のなかのリンパ球ががん化する病気である。そのなかでもリンパ外組織(節外臓器)に発生する節外性NK/T細胞リンパ腫、鼻型(ENKTCL)は、幼少期から成人期にかけて感染するヘルペスウイルスの一つEBウイルス(Epstein-Barr Virus)の持続的な感染により発症する悪性腫瘍で、主に上気道(鼻腔や咽頭など)に発症する。この疾患は特に日本を含むアジアや南米で高頻度に認められる希少疾患で、治療が効きにくい難治性のリンパ腫として知られている。悪性リンパ腫の1%弱を占め、年間300〜400人ほどが発症する。男性の方がやや発症しやすく、60歳前後が好発年齢と言われている。
ENKTCLは、EBウイルスが産生するLMP1、LMP2、EBNA1などのタンパク質が腫瘍発生に関与すると考えられている。また、がん抑制遺伝子TP53をはじめとするさまざまな遺伝子異常も報告されているが、これらの因子が実際の生体内で腫瘍発生や進展にどのように寄与しているのかは、十分に解明されていなかった。また治療面では、薬剤耐性に関わるP糖タンパク質の過剰発現により従来の抗がん剤が効きにくいことが知られている。現在の標準治療であるL-アスパラギナーゼを含む多剤併用化学療法を用いても、進行期の患者の予後は依然として不良であり、新規治療法の開発が急務となっている。
遺伝子異常とEBウイルス感染を再現し、腫瘍免疫微小環境の評価可能な動物モデルが必要
ENKTCLのがん細胞ではがん抑制遺伝子をはじめとするさまざまな遺伝子異常が報告されており、最も頻度の高い遺伝子がTP53であることが知られているが、このTP53の異常が実際の生体内で腫瘍発生や進展にどのように寄与しているのかは、十分に解明されていなかった。また、EBウイルスが産生するLMP1、LMP2、EBNA1などのタンパク質についても生体でのENKTCLの発症において、どのような機能的役割を果たしているかという点についてもほとんど理解されていない。
さらに、ENKTCLでは免疫機能を調整するPD-L1の構造異常をはじめとする免疫関連分子の異常が高頻度に認められることから、腫瘍細胞を取り巻く環境(腫瘍免疫微小環境)が病態形成に重要な役割を果たすと考えられている。しかし、これまでの研究では主に培養細胞や免疫不全マウスへの異種移植モデルが用いられてきたため、腫瘍免疫微小環境を適切に評価することができなかった。このような背景から、ENKTCLの病態解明と新規治療法の開発には、ヒトENKTCLで高頻度に認められる遺伝子異常を再現し、慢性的なEBウイルス感染の影響を反映しつつ、腫瘍免疫微小環境の評価が可能な動物モデルの確立が重要な課題となっていた。
NK細胞特異的TP53欠失により造血系・唾液腺にNK細胞リンパ腫を自然発症するマウス開発
NK細胞特異的に細胞のがん化を防ぐがん抑制遺伝子TP53(マウスではTrp53)を欠失させることで、造血系および唾液腺にNK細胞リンパ腫を自然発症するマウスモデルの開発に世界で初めて成功した。これまでの研究で用いられていた培養細胞や免疫不全マウスへの異種移植モデルに比べて、腫瘍細胞と免疫微小環境の相互作用を評価できる点が優れている。以後の成果については、本マウスモデルを用いて行った。
作製したマウスモデルをもとに、NK細胞リンパ腫の発症メカニズムを解析した。このマウスモデルでは、全個体が致死性のNK細胞リンパ腫を発症した。注目すべき点として、その80%以上のマウスが1年以上の生存期間を経て発症するという特徴が明らかになった。
さらに興味深いことに、血液系の悪性腫瘍であるにもかかわらず、この腫瘍は脾臓やリンパ節に加えて、唾液腺にも高頻度に形成されることが判明した。発症までに長い年月を要し、さらに造血組織以外に発症する点は、ヒトENKTCLが上気道に好発するという臨床的特徴と類似している。腫瘍細胞の解析から、他のマウスへの移植により腫瘍を再形成する能力を持つことが確認され、悪性腫瘍としての性質が実証された。また、これらの腫瘍細胞は、NK細胞系列においてやや未熟な段階の細胞に特徴的な表現型を示すことも明らかになった。
未発症期のマウス、唾液腺にやや未熟な性質を持つNK細胞が特異的に増加
NK細胞リンパ腫の発症機序を理解し、予防や早期発見につなげるため、腫瘍発症前の段階における細胞の変化を詳細に解析した。若齢のマウス(未発症期)の組織を詳しく調べたところ、唾液腺において特徴的な変化を発見した。具体的には、後に腫瘍化するNK細胞と同様の、やや未熟な性質を持つNK細胞が特異的に増加していることがわかった。
通常、唾液腺には組織常在性NK細胞(組織に定着して免疫機能を担うNK細胞)が多く存在している。一方、脾臓には主に血液中を循環するNK細胞が存在する。興味深いことに、リンパ腫を発症したマウスでは、唾液腺の腫瘍だけでなく、脾臓に形成された腫瘍でも組織常在性NK細胞の特徴が認められた。さらに重要な発見として、ヒトのENKTCL患者の腫瘍細胞でも同様に組織常在性NK細胞の特徴が確認された。これらの知見から、組織常在性NK細胞がNK細胞リンパ腫の起源となる可能性が示唆された。
EBウイルス産生のLMP1が免疫微小環境変化させ腫瘍増殖を加速、経路遮断で生存期間延長
ENKTCLはEBウイルス感染と強く関連したがんとして知られている。今回の研究では、EBウイルスが作り出すLMP1というタンパク質に着目し、NK細胞リンパ腫の発症における役割を解明した。NK細胞特異的にTrp53を欠失させたマウスにLMP1を発現させたところ、腫瘍の発症が著しく早まることを発見した。さらに、このマウスモデルでは、ヒトのENKTCLで特徴的に見られる組織の壊死や異常な血管増生などが再現され、より実際の病態に近い実験モデルの確立に成功した。
特筆すべき発見は、LMP1が腫瘍免疫微小環境を大きく変化させることである。具体的には、LMP1がウイルス感染などに対する生体防御に重要な役割を果たすタンパク質であるインターフェロンγの産生を促し、それによって免疫系の司令塔である樹状細胞と呼ばれる免疫細胞が増加する。この増加した樹状細胞は、CXCLという物質を産生する。腫瘍細胞の表面には、このCXCLを受け取るCXCR受容体が存在しており、この相互作用によって腫瘍の増殖が加速することが明らかになった。実際の患者の腫瘍組織でも、CXCLとCXCRの発現が確認されたことから、この経路を治療標的として検討した。マウスモデルを用いた実験で、この経路を薬剤で遮断することにより生存期間が延長することが示され、新たな治療戦略となる可能性が示された。
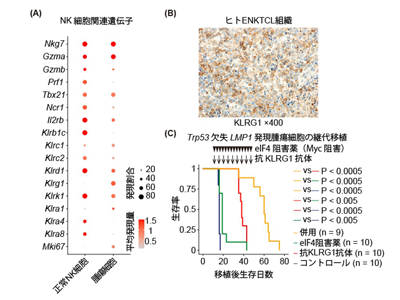
MYC抑制eIF4阻害剤・KLRG1標的の治療薬の併用でもマウス腫瘍の増殖抑制を確認
今回の研究では、微小環境を標的とした新規治療に加えて、リンパ腫細胞自体を治療標的とする二つの重要な分子を発見した。一つ目は、がん遺伝子として知られるMyc遺伝子である。開発したマウスモデルの腫瘍では、このMyc遺伝子のコピー数が増加しており、特にLMP1を発現させたモデルで顕著だった。実際のENKTCLの患者の検体でも、同様にMYC遺伝子の活性が上昇していることを確認した。
二つ目は、KLRG1という分子である。正常のNK細胞と腫瘍細胞の遺伝子発現を詳しく解析したところ、この分子が腫瘍細胞で特異的に発現していることを発見した。さらに、リンパ腫を発症したマウスの腫瘍細胞を、KLRG1を発現する細胞と発現しない細胞に分けて別のマウスに移植する実験を行ったところ、KLRG1を発現する細胞のみがリンパ腫を再び形成することがわかった。重要な点として、このKLRG1は患者の腫瘍でも発現していることが確認された。
これらの知見に基づき、MYCの働きを抑制するeIF4阻害剤とKLRG1を標的とする治療薬を組み合わせる新しい治療戦略を検討した。マウスモデルでの実験では、この併用療法が単独治療と比較して、より効果的に腫瘍の増殖を抑制することが示された。現在、この治療法の作用機序のさらなる解明と臨床応用に向けた研究を進めている。この新しい治療戦略は、既存の治療法では十分な効果が得られない患者に対する、新たな治療選択肢となることが期待される。
他のリンパ腫やEBウイルス関連がんにも応用できる可能性
今回の研究では、NK細胞特異的なTrp53欠損マウスモデルを用いてENKTCLの発症メカニズムを解明し、Trp53欠損による唾液腺での組織常在性NK細胞の増加、EBウイルス由来のLMP1がもたらす腫瘍免疫微小環境の変化、そしてCXCL-CXCRシグナルやMyc、そしてKLRG1の病態への関与を明らかにした。これらの知見に基づき、これらの分子を標的とした新規治療戦略を提案した。
今後は、これらの治療戦略の臨床応用に向けた研究を進めていく。現在の標準治療に抵抗性を示すENKTCL患者に対する新たな治療選択肢として、特に期待される。「研究で得られた知見は、他のリンパ腫やEBウイルス関連がんの治療法開発にも応用できる可能性があり、がん治療全体の発展に寄与することが期待される」と、研究グループは述べている。
▼関連リンク
・国立がん研究センター プレスリリース




