低出生体重で出生した女性の子は胎児発育不全や低出生体重となる可能性が高い
東北大学は10月21日、低出生体重のモデルマウスを確立し、成人期や次世代に及ぼす健康への負の影響とその機序を明らかにしたと発表した。この研究は、同大大学院薬学研究科臨床薬学分野の佐藤恵美子准教授、堰本晃代助手(研究当時)、髙橋信行教授、東北大学大学院医学系研究科腎臓内科学分野の三島英換非常勤講師、帝京大学の三枝大輔准教授、三重大学の池田智明教授らの研究グループによるもの。研究成果は、「iScience」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
日本では年間出生数の約10%が低出生体重児、1%が超低出生体重児であり、出生時年齢の高齢化および新生児医療の進歩に伴う低出生体重児の救命率の向上によりその割合は年々増加している。胎児期および出生後早期の環境因子がその後の人生における疾病へ影響を及ぼすことを強調するDevelopmental Origins of Health and Disease(DOHaD)の観点からも、低出生体重は高血圧や慢性腎臓病(CKD)などの将来の健康リスクを増加させることが知られている。さらに低出生体重で産まれた女性は、妊娠すると妊娠高血圧症候群を発症するリスクが高くなり、またその子孫は胎児発育不全や低出生体重となる可能性が高くなるため、世代を越えて健康面での負の連鎖が持続する。低出生体重に関連するリスクの長期化を軽減するため、世代を越えて及ぼす影響の機序の解明と、治療法の開発が望まれている。
ヒトの低出生体重の病態を反映した動物モデルを確立
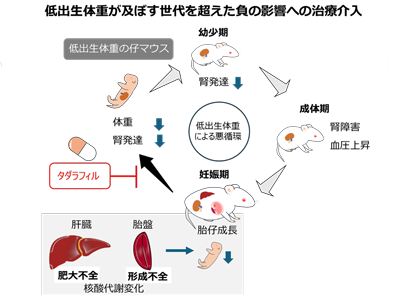
研究グループはまず、子宮灌流圧低下(reduced uterine perfusion pressure;RUPP)手術を利用して、低出生体重モデルマウスを新たに確立した。このマウスの特徴として、胎仔・出生時期に体重が少なく、腎臓の発達の遅れを認め、さらに成体期には腎臓で糸球体の障害を認め、高血圧を認めるなどヒトの低出生体重の病態を反映している動物モデルとして利用できることがわかった。
妊娠中のモデルマウスにタダラフィル投与、仔マウスの出生時体重増・腎臓発達や高血圧改善
低出生体重モデルを用い、ホスホジエステラーゼ5(PDE5)阻害薬であるタダラフィルの低出生体重に対する治療可能性について評価した。低出生体重モデルマウスの妊娠中の母体にタダラフィルを投与した結果、胎仔および出生時の体重は増加し、腎臓の発達の改善を認めた。さらに、成体期の高血圧の軽減も確認された。
低出生体重マウス妊娠<血管新生↓<肝臓酸素↓<解糖系↑<核酸代謝↓<仔も低体重
続いて研究グループは、モデルマウスを用いて低出生体重が次世代に及ぼす機序について調べた。低出生体重で産まれたメスマウスが成長した後に妊娠した際に、母体の肝臓や胎盤の重量が有意に少なく、胎仔も出生時体重が少なくなっていた。この結果から、胎盤の発達が及ぼす仔の発育障害の機序ついて分析を行った結果、低出生体重グループでは胎盤の血管新生関連の遺伝子発現が上昇し、さらに胎盤の血管網が疎であることがわかった。
胎盤における代謝経路の変化を明らかにするため、代謝物解析を行った結果、低出生体重グループの胎盤ではタウリンの代謝が変化していることがわかった。また、妊娠中は胎児の成長を支えるために代謝要求が増大するため、肝臓は肥大するが、低出生体重グループでは十分に肝臓が肥大していないことが判明。このメカニズムの解明とそれによる児の発達への影響について調べるため、肝臓の解析を行った結果、肝臓の肥大に関連する遺伝子発現が減少しており、低酸素と血管新生の指標となる遺伝子発現は低出生体重グループで有意に上昇していた。さらに低出生体重グループの肝臓では、プリン体などの核酸代謝経路に顕著な変化を認めた。
これらの結果から、低出生体重グループの肝臓では、妊娠における血管の新生が不全となり、その結果として肝臓が低酸素状態に陥り、解糖系優位な代謝経路に変化したことで核酸代謝経路が停滞した可能性が考えられた。
「今回、低出生体重モデル動物を確立することにより、成人期、妊娠期、およびその後の世代に影響を及ぼす低出生体重による未熟な腎臓および臓器発達の重要性を浮き彫りにした。低出生体重に対する治療介入を開発することは、低出生体重と未熟な臓器発達の悪影響を軽減し、低出生体重に関連する将来のリスクを軽減するために重要であることを示した。低出生体重が関わる健康問題に対する予防・治療薬の開発に貢献するものと期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



