カルシウム濃度上昇で活性化する酵素カルパイン、筋分化の進行に関与する可能性
理化学研究所(理研)は10月4日、カルシウム依存性タンパク質分解酵素カルパインの一つ、カルパイン5が骨格筋の形成過程で活性化し、筋タンパク質の合成や核の位置決めを制御することを発見したと発表した。この研究は、理研開拓研究本部伊藤ナノ医工学研究室の森島信裕客員研究員(現 光量子工学研究センター先端レーザー加工研究チーム客員研究員)、伊藤嘉浩主任研究員(現 光量子工学研究センター先端レーザー加工研究チーム客員主管研究員)らの研究グループによるもの。研究成果は、「Journal of Biological Chemistry」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
体を構成する組織や臓器は細胞分化によって作られる。細胞分化は前駆細胞の中のタンパク質をはじめとする構成成分や細胞内外の構造が変化することによってもたらされる。こうした変化は遺伝子発現(DNAが転写されてmRNAが作られ、さらにそれを基にしてタンパク質が作られる過程)を調節する多数の転写調節タンパク質(転写調節因子)の働きによってなされる。骨格筋形成もその一例で、筋分化特異的転写調節因子が中心的な働きをすることによって筋芽細胞(骨格筋前駆細胞)から筋肉細胞が作られることが知られている。転写調節因子はiPS細胞のような未分化細胞を使って人為的に組織、臓器を作り出す再生医療においても重要である。
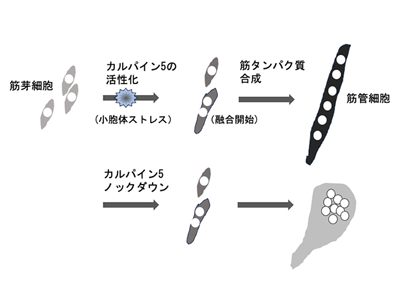
筋芽細胞は分化誘導条件下で細胞分裂を停止し、多数の筋芽細胞同士が融合して多核の大きな細胞である筋細胞が形成される。増殖がストップすると、細胞融合が始まる前の段階にある筋芽細胞の中で小胞体という細胞小器官からカルシウムが細胞質ゾル(細胞質の可溶性部分)へ流出し、小胞体ストレスが引き起こされる。この現象が起こると補償作用として細胞は細胞外からカルシウムを取り込むため、細胞質ゾル中では小胞体と細胞外からのカルシウムによってカルシウム濃度が上昇する。細胞にはカルシウムが結合すると活性化するタンパク質分解酵素(カルパイン)が不活性な状態で常在していることから、研究グループは小胞体ストレスが起きる時期にカルパインが活性化し、筋分化過程の進行に何らかの役割を果たしているのではないかと考えた。ヒトやマウスのカルパインは15種類のメンバーから成る。そのうちの一つ、カルパイン5は多くの器官、組織に存在している。
筋分化誘導24〜35時間後、カルパイン基質候補が数回切断されることを確認
研究グループは、筋分化研究において最もよく用いられている培養筋芽細胞の一つ、マウスC2C12細胞の筋分化過程を調べた。カルパインによるタンパク質切断は限定分解と呼ばれる様式で起こり、基質タンパク質中の特定配列を切断して基質を断片化する。そこで、限定分解を解析するのに適しているウエスタンブロット法を用いて、筋芽細胞中でカルパインの基質候補(STAT3、c-Myc)が切断されているかを探った。カルパインによるタンパク質切断はこれまで主に病理的条件で見つかってきたが、STAT3やc-Mycは増殖や分化の制御に関わる転写調節因子で、血小板など生細胞中でカルパイン1や2によって切断されることが知られていた。
筋分化過程は比較的ゆっくりしたスピードで進み、細胞増殖から細胞分化への切り替えに1、2日、さらに筋収縮を起こす筋細胞ができるまでには1週間程度の日数を要する。研究グループは、小胞体ストレスが起こる分化誘導開始翌日に1時間刻みで解析を行った。その結果、C2C12細胞を分化誘導条件下において24~35時間の間に数回、それぞれ約1時間の間STAT3、c-Mycが切断されることを見出した。
カルパイン5遺伝子ノックダウンによりSTAT3・c-Myc切断抑制、筋原線維形成に失敗
これらの切断によってSTAT3やc-Mycの全長タンパク質が減少するが、そのたびに新たなタンパク質合成によってタンパク質の量は元のレベルに復帰した。このように間欠泉のように起こる切断現象は、タンパク質分解の様式としては珍しい例である。切断により、STAT3やc-Mycは一時的に無力化される状態になるか、または切断によって性質を変えられている可能性がある。
カルパインの一つ、カルパイン5ができるだけ作られなくなるように遺伝子ノックダウンした筋芽細胞中ではSTAT3やc-Mycの切断が抑制された。このことからカルパイン5が分化過程にある筋芽細胞中で活性化することが示唆された。このカルパイン5ノックダウン筋芽細胞(ノックダウン細胞)を分化誘導すると、元の細胞と同様に細胞融合を起こして多核細胞を形成した。ところが、筋肉の収縮運動を起こす筋原線維の構成成分であるミオシンやアクチニンは正常な筋細胞に比べて少量しか作られず(アクチニンの場合5%以下)、筋原線維がきちんと形成されなかった。また、正常な筋細胞中では多数の核が細胞全体にわたって分布するが、ノックダウン細胞中の核は1か所に凝集していた。さらに、筋分化の進行に伴って減少するはずの活性型STAT3が高いレベルを保ったままであった。人為的に作った活性型STAT3を筋芽細胞中で発現させると、分化誘導条件下でのミオシンやアクチニンの合成が抑えられていた。これらの結果から、カルパイン5の間欠泉様の活性化がこれらのタンパク質レベルを正しく制御するために必要だと考えられる。
タンパク質分解が転写調節に影響し筋タンパク質量をコントロールする新たなメカニズム
筋分化の制御機構はこれまで主に遺伝子発現制御(転写調節因子による制御)の観点から理解されてきたが、今回の研究で、一過的なタンパク質分解が転写調節に影響を与えることで筋タンパク質量をコントロールするという新たなメカニズムが重層的に働いていることが示唆された。研究グループはSTAT3、c-Myc以外の転写調節因子もカルパイン5によって切断される可能性があると考えている。このようなタンパク質分解がどのようなメカニズムで遺伝子発現に影響しているかを解明することは重要な研究テーマであり、現在研究グループは、レーザー加工によって作った微小チップ上での細胞培養系開発にも取り組み、細胞分化解析の効率化も目指している。
カルパイン5が原因となる疾病の治療薬開発にもつながると期待
カルパイン5の活性化を起こす細胞内の条件を特定し、細胞内カルシウムの動きを詳しく明らかにしていけば、カルパイン5の働きを増強することによって筋肉作りを促進する薬剤の開発につなげられる可能性がある。また、カルパイン5の遺伝子異常は血管新生炎症性硝子体網膜症の原因となることが近年明らかになっている。カルパイン5の基質となるタンパク質の同定をさらに進め、切断箇所のアミノ酸配列を基にしたカルパイン5の阻害剤を開発すればカルパイン5が原因となる疾病の治療薬を開発することにも役立つと考えられる。
カルパインの研究では日本の研究者が国際的に大きな貢献をしてきた。しかし、カルパインが健康な生体内で果たす役割のほとんどは不明である。「本研究がカルパインに関する研究の新展開の一つのきっかけになることも期待される」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



