薬剤耐性の詳細メカニズムは未解明、RET阻害薬治療後でも生き伸びるがん細胞が存在?
がん研究会は9月13日、薬剤耐性の芽となる治療残存細胞に関連する遺伝子を同定するために、RET融合遺伝子陽性肺がん患者から樹立したがん細胞株を用いて、ヒトのゲノムワイドCRISPR/Cas9スクリーニングを行い、MIG6を欠損した肺がん細胞では、ごく微量のEGFによってEGFRが活性化してRET阻害薬に耐性となること、その耐性は抗EGFR抗体の併用で克服できる可能性を示したと発表した。この研究は、同所がん化学療法センター基礎研究部の片山量平部長、魏薪兆(Weixi Zhao)氏(東京大学大学院新領域創成科学研究科博士課程大学院生)らの研究グループによるもの。研究成果は、「Cancer Letters」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
RET(Rearranged during Transfection)は、細胞の成長、分化、そして生存を制御する受容体型チロシンキナーゼをコードするがん原因遺伝子であり、遺伝子変異や融合遺伝子形成などの異常が、がんの発生に寄与することが知られている。RET融合遺伝子は、2015年に、同会病理部長の竹内賢吾博士や、国立がん研究センターの河野博士らによって発見され、さまざまなRET阻害薬が治療薬として開発されてきた。日本では、RET阻害薬のセルペルカチニブ(LOXO-292)が、米国ではプラルセチニブ(BLU-667)も承認され治療薬として臨床応用されている。しかし、他の分子標的薬と同様に、RET阻害薬に対する耐性がんの出現によって再増悪してしまうことが問題となっている。
薬剤耐性のメカニズムとしては、RET阻害薬が結合するRETチロシンキナーゼ領域に起こる二次変異や、EGFRやKRASなどのバイパス経路の活性化が報告されてきているが、その詳細な耐性メカニズムはまだ不明だ。また、薬剤耐性が出現するには、そもそもRET阻害薬治療で残存し生き延びてしまうがん細胞がいることが原因と考えられた。
患者細胞株を用いてゲノムワイドスクリーニングを実施
研究グループは、独自に患者検体から樹立したRET融合遺伝子陽性肺がん細胞株を用いてCRISPR/Cas9によるゲノムワイドスクリーニングを実施し、治療残存細胞に関与する因子と、新規の薬剤耐性メカニズムの探索、そしてその克服法の解明を目指して研究を行った。
具体的には、RET融合陽性肺がん患者から検査などの残余組織検体を用いて、がん細胞株の樹立を行った。樹立できたがん細胞株LCC-190とLCC-175は、それぞれ、CCDC6-RETとKIF5B-RET融合遺伝子を有していた。これらの細胞株に加えて、購入可能なRET融合陽性非小細胞肺がん細胞株LC2/adを用いて実験を行った。
MIG6遺伝子欠損がRET阻害薬抵抗性への関与を示唆、細胞実験で
まず、RET阻害薬への感受性を評価するため、LC2/ad細胞株とLCC-190細胞株を用いて、それぞれ2次元平面培養(2D)条件、および胸水環境を模倣した3次元浮遊培養(3D)環境で培養した。それらをセルペルカチニブおよびプラルセチニブで処理し、細胞の増殖、RETチロシンキナーゼおよびその下流シグナルの阻害、細胞死の指標であるPARPタンパク質の発現量を評価した。その結果、LC2/adとLCC-190細胞は、2D条件ではRET阻害薬への耐性を示したが、3D浮遊培養条件では薬剤感受性を示した。
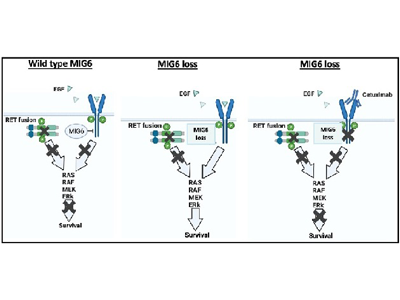
次に、RET阻害薬への抵抗性に関連する遺伝子を特定するためにLCC-190細胞を用い、CRISPR/Cas9の全ゲノムノックアウトスクリーニングを実施した。LCC-190細胞に約12万種類のsgRNAライブラリ(1つの遺伝子をノックアウトするために3~6個のsgRNAが含まれる)を導入し、RET阻害薬を約9日間処理して、その後生存した細胞に含まれたsgRNAを調べた。その結果、ERRFI1(MIG6)遺伝子のノックアウトがRET阻害薬抵抗性に関与していることが強く示唆された。
MIG6ノックアウト細胞では、EGFR経路が過剰に活性化され、薬剤耐性誘導
この結果を検証するため、LC2/adとLCC-190細胞を用いて、追加で異なる配列を持つsgRNAも用いてMIG6のノックアウトを行った。その結果、MIG6ノックアウト細胞では、EGFR経路が過剰に活性化され、薬剤耐性が誘導されることが明らかになった。特にヒトの血中濃度に匹敵する1ng/mLという低濃度のEGFを共処理することで、顕著なEGFR活性化が認められRET阻害薬耐性が認められた。これに対して、逆にMIG6を過剰発現させた細胞では、RET阻害薬への感受性が回復し、耐性が克服された。以上より、EGFR経路の負の制御因子であるMIG6遺伝子の欠損はRET阻害薬耐性に寄与することが示唆された。
RET阻害薬とEGFR阻害抗体の併用により薬剤耐性を克服できる可能性
MIG6の欠損によるRET阻害薬耐性はリガンド依存的なEGFRの過剰活性化が主な原因であると考え、その克服には、EGFRの阻害が有効であると推定した。そこで、MIG6を欠損させたLC2/adとLCC-190細胞を用いてRET阻害薬とEGFR阻害薬(アファチニブや抗EGFR抗体セツキシマブ)の併用実験を行った。コロニー形成アッセイおよび細胞生存率試験を通じて、これらの併用療法が治療残存細胞数を減少させ、RET阻害薬耐性細胞の薬剤感受性を回復させることが明らかになった。免疫不全マウスにLCC-190細胞を移植したゼノグラフトモデルを用いてRET阻害薬とEGFR阻害抗体を併用する治療実験を行ったところ、腫瘍の増殖が顕著に抑制された。
一方、同様にRET陽性肺がん患者より樹立したRET融合遺伝子陽性肺がん細胞株のLCC-175はKIF5B-RET融合遺伝子を有しているにもかかわらず、2Dでも3Dの培養条件でもRET阻害薬に強い抵抗性を示した(初期耐性)。詳細な解析からLCC-175細胞ではEGFR経路が強く活性化されており、RET阻害薬に耐性を示していた。そこでRET阻害薬とアファチニブを併用し、細胞生存率試験を行った結果、この併用療法がLCC-175の増殖を顕著に抑制した。以上の結果より、LCC-175細胞に対しても、RET阻害薬とEGFR阻害薬を併用することで薬剤耐性を克服できることが示唆された。
今回の研究から、EGFR経路を抑制するMIG6遺伝子の欠損はRET阻害薬耐性に寄与することが示唆され、EGFR経路の活性化がRET阻害薬耐性の1つの原因であることを基礎研究レベルで示し、RET阻害薬とEGFR阻害薬の併用による耐性克服の可能性が判明した。「RET阻害薬抵抗性に関わるメカニズムを同定すると共にその克服法候補を発見することができており、今後の治療法開発に貢献しうる研究成果である」と、研究グループは述べている。
▼関連リンク
・がん研究会 プレスリリース




