約3割でドライバー変異が見つからない肺腺がん、日本人データの統合的解析が必要
国立がん研究センターは9月13日、Notchシグナルに関わることが知られているMAML2遺伝子が、分子標的薬の治療対象とならない肺腺がん症例(ドライバー遺伝子変異/転座陰性症例)において、発現が低下していることを見出したと発表した。この研究は、同センター研究所医療AI研究開発分野の浅田健外来研究員(理化学研究所 革新知能統合研究センター・上級研究員)、浜本隆二分野長、ゲノム生物学分野の河野隆志分野長、国立がん研究センター中央病院、理化学研究所らの研究グループによるもの。研究成果は、「Molecular Cancer」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
日本における死因の第一位は悪性腫瘍であり、その中でも肺がんは部位別死亡数の第一位である。肺腺がんは肺がんの中でも最も発症頻度が高く、EGFR、KRAS、ALK遺伝子などに変異が生じることが知られている。これらのドライバー変異を調べることは、分子標的薬を用いた治療法の選択において重要だが、残念ながら全ての症例で変異が見つかるわけではない。約30%の症例ではドライバー変異が見つからないため、分子標的薬を用いることができない。さらに、肺腺がんには人種差があることが知られており、日本人の肺腺がん研究には、日本人のデータを利用した統合的な解析が求められている。
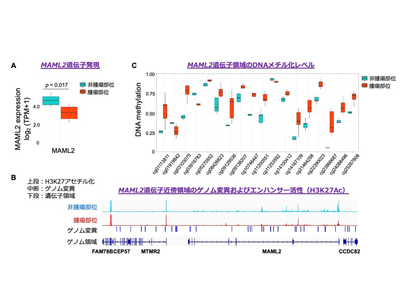
近年、次世代シーケンシングの普及によりゲノム・エピゲノム・トランスクリプトームといったさまざまなオミックスデータが収集され、解析されている。これまでに、日本人の肺腺がん症例を対象に、ドライバー変異が見つかっていない症例に着目した全ゲノム解析とChIP-seq解析から、ゲノム構造異常とスーパーエンハンサー形成によるHER2遺伝子の発現上昇が報告されている。今回の研究では、引き続きドライバー変異が未同定の症例を対象として、ゲノム・エピゲノム・トランスクリプトームを含む複数のオミックスデータを活用した統合マルチオミックス解析とクラスター分析を行った。
ドライバー変異未確認の肺腺がん症例、腫瘍部位でMAML2遺伝子の発現低下
ドライバー変異が確認されていない肺腺がん症例において、腫瘍部位と非腫瘍部位のサンプルを用いて解析を行ったところ、腫瘍部位では、転写に関与するとされるMAML2遺伝子の発現が低下していることが明らかとなった。MAML2は粘表皮がんにおいて、CRTC1との融合遺伝子がドライバー変異として知られている。また、MAML2遺伝子は種を超えて保存されており、Notchシグナル下流の遺伝子発現を制御することが報告されている。今回、マルチオミックス解析から、MAML2の遺伝子領域においてゲノム変異が認められ、同時にエンハンサー活性の低下と高DNAメチル化が見出された。
MAML2遺伝子発現との相関から、予後予測マーカーとして5つの遺伝子を同定
MAML2遺伝子と他遺伝子との相関解析から、発現の相関が高かった上位15個の遺伝子を抽出し、発現レベルに応じて高発現群・低発現群の2群に分けて生存時間分析を行ったところ、FAT4、 HMCN1、CD302、UTRN、FOXN3の5つの遺伝子が予後予測のバイオマーカーであることが明らかとなった。今後、同定した予後バイオマーカーが関わるシグナルパスウェイを詳細に解析することで、ドライバー変異が見つかっていない日本人肺腺がん症例の生存に関わる機序解明が期待される。
機械学習により精緻な患者層別化に成功、発現変動解析で創薬標的候補も明らかに
5つのマーカー遺伝子ごとの生存時間分析の結果を基に、予後良好群と予後不良群に応じてラベルをつけて、機械学習に利用できるデータを作成し、クラスター分析を行った。CD302、FAT4、FOXN3の生存時間分析結果を活用した解析により、さらに精緻に患者層別化できることが明らかとなった。また、予後良好群と予後不良群との間で遺伝子の発現変動解析を行うことで、有意に発現が上昇している遺伝子および低下している遺伝子を明らかにした。これらの遺伝子は、将来的な創薬標的になる可能性があると考えられる。
新たな創薬標的探索の基盤となることに期待
この研究により、ドライバー変異が見つかっていない日本人の肺腺がん症例において、発がんに関係する新たな分子メカニズムが解明され、今後の創薬への可能性が見出された。また、機械学習を活用した解析により、精緻な患者層別化ができることも明らかとなった。「これらの研究成果は今後の肺がん研究の進展に寄与するとともに、新たな創薬標的探索の基盤となることが期待される」と、研究グループは述べている。
▼関連リンク
・国立がん研究センター プレスリリース



