進行がん患者の80%でがん悪液質、全がんに共通する課題
東京薬科大学は9月12日、進行がんの病態でしばしばみられる筋萎縮と体重減少の原因となる新たな免疫細胞を発見したと発表した。この研究は、同大生命科学部の原田浩徳教授、立命館大学薬学部の林嘉宏教授らの研究グループによるもの。研究成果は「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん悪液質は、「通常の栄養サポートでは完全に回復することができず、進行性の機能障害に至る、骨格筋量の持続的な減少を特徴とする多因子性の症候群」と定義されている。悪液質は、がんの種類を問わず進行がんの患者の80%でみられ、治療効果の減弱やQOL低下の要因となり、がん患者が亡くなる原因の30%前後を占めている。
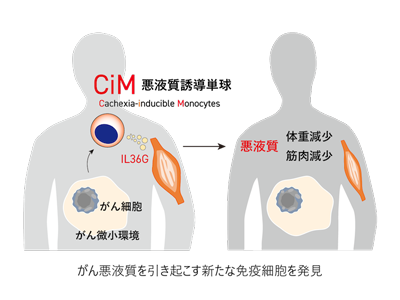
最近のがん研究で、からだを守ってくれるはずの免疫細胞が、がんの発生や進行にかかわっていることが明らかになっている。その中でも、自然免疫細胞とよばれる単球やマクロファージなどは、がんを取り囲む環境(がん微小環境)で特に重要な役割を担っている。がん細胞がこれらの免疫細胞の性質を変化させて、転移しやすい環境を整えたり、がんを攻撃する免疫から逃れる力を獲得したりしていることがわかってきた。一方、がんの進行と密接にかかわる悪液質が起こるメカニズムの解明は十分には進んでいない。がん悪液質が起こる仕組みを解き明かし、新たな治療法を開発することは、すべてのがんに共通する課題と言える。
悪液質の症状がよくみられるCMMLに着目、モデルマウスを樹立し詳細に解析
がん悪液質が起こる仕組みを調べるため、研究グループは、慢性骨髄単球性白血病(CMML)という血液のがんに着目した。CMMLは持続的に単球が増えつづける血液がんで、CMML患者では、体重減少や筋肉の萎縮といった悪液質の症状がよくみられることが知られている。こうした悪液質の症状は他の血液がんではあまりみられないことから、CMML患者で増えている単球の中に、悪液質の原因となる特殊な細胞集団がいるのではないかと考えた。
この仮説を検証するために、同グループが樹立したCMMLのモデルマウスを詳細に解析した。CMML患者から同定されたNUP98-HBO1という融合遺伝子を使って樹立されたこのモデルでは、CMML患者と同様に単球が増加し、体重減少がみられる。このマウスを詳しく調べると、健康なマウスに比べて筋肉の萎縮と筋力低下が進んでいることがわかった。
このマウスから単球細胞だけを集めてきて、マウスの筋線維細胞(C2C12細胞)と一緒に培養したところ、筋線維の萎縮が観察された。この結果は、CMMLマウスで増えている単球の中に、筋肉を減少させるはたらきを持った特別な細胞が存在するということを意味している。
悪液質を発症したマウスで、筋萎縮に関連のIL36Gを産生する単球を発見
続いて、RNAシークエンシング(RNA-Seq)という方法で単球細胞内のすべての遺伝子の発現レベルを調べ、体重減少がみられたCMMLマウスの単球でだけ発現の上昇がみられる複数の遺伝子を特定した。そして、フローサイトメトリーなどの手法を用いて、それらの遺伝子が実際にタンパク質として単球に発現しているかを検証した。これにより、悪液質を発症したCMMLマウスの単球の中に、健康なマウスの単球ではみられないCD38という抗原が発現し、筋肉の萎縮を引き起こすIL36Gというサイトカインを産生する特殊な細胞集団がいることをつきとめた。こうして発見した単球を、「Cachexia-inducible Monocyte:CiM(悪液質を誘導する単球)」と名付けた。
CiMの特徴を詳しく理解するために、1細胞レベルで網羅的に遺伝子の発現を調べることができるシングルセルRNA-Seq解析を行った。すると、CiMが好中球に似た性質を持つ特殊な単球であることがわかった。また、ちょうど体重減少がはじまる前にCiMが出現すること、CiMの誘導にはトール様受容体4(TLR4)の刺激が重要であるということもわかった。進行がんの患者の血液中では、HMGB1やS100A9などのタンパク質が上昇していることが報告されている。これらのタンパク質はTLR4を刺激することが知られており、CiMの誘導にかかわっている可能性があるとわかった。
血液中の単球増加が、血液がんだけでなくさまざまな固形がんの患者においても予後不良と関連することが報告されている。そこで、乳がんや皮膚がんのモデルマウスを解析したところ、がんの進行とともにCiMが現れ、悪液質を引き起こすことがわかった。さらに、大腸がんや腎臓がん患者の単球の遺伝子発現データを解析し、がんの進行にともなってCiMが出現していることを確認した。これらの結果は、筋肉の減少を引き起こすCiMの出現が、がんの種類を問わず、がん悪液質に共通する普遍的な現象であるということを示唆している。
IL36G阻害で悪液質の発症抑制、ドラッグ・リポジショニングによる応用に期待
最後に、進行がんマウスで、単球のIL36G産生を抑えたり、筋肉のIL36受容体を阻害することで、CiMやIL36Gが悪液質の治療標的となるかどうかを検証した。その結果、CiMに関連したIL36Gのはたらきを阻害することで、悪液質の発症が抑制されることが確認された。
現在、がん悪液質でみられる筋肉の減少を劇的に改善することができる治療法はない。今回の発見は、がん悪液質に対する新たな治療法開発をめざすうえで、非常に重要な一歩となる。他の疾患に目をむけると、IL36受容体やCD38に対する抗体医薬が炎症性疾患や血液がんの治療にすでに使われている。「今後、ドラッグ・リポジショニングにより、ヒトでの安全性と体内動態が確認されているこれらの治療薬を、がん悪液質の治療に応用することができれば、新しい治療法の開発にかかる時間やコストを大幅に削減できる可能性がある」と、研究グループは述べている。
▼関連リンク
・東京薬科大学 プレスリリース




