根本的な治療法がない急性腎障害、悪化防ぐ仕組み解明は喫緊の課題
筑波大学は9月6日、マクロファージの炎症抑制能を制御することが報告されている転写因子MAFBに着目し、急性腎障害におけるマクロファージの機能を解析した結果を発表した。この研究は、同大医学医療系の濱田理人准教授の研究グループによるもの。研究成果は、「The Journal of Immunology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
急性腎障害は重篤な予後につながるにも関わらず、その根本的な治療法は確立されておらず、急性腎障害の悪化を防ぐ仕組みの解明は喫緊の課題だ。このような急性炎症下では、脂質メディエーターと呼ばれる生理作用を持つ脂質が重要な役割を果たす。脂質メディエーターには炎症を促進するもの、抑制するものの両方が存在し、そのバランスが炎症の予後に大きな影響を与える。マクロファージは、脂質メディエーターを産生する主要な細胞の一つだが、マクロファージが炎症性脂質メディエーターの産生量やバランスを制御するメカニズムについては詳細が不明なままだった。
虚血性急性腎障害誘導マウス、腎臓内にMAFB陽性マクロファージが増加
今回の研究では、急性腎障害下でのマクロファージの機能を解明するため、マクロファージの炎症抑制能において重要な役割を果たすことが知られる転写因子MAFBに着目。マクロファージ特異的にMafbを欠損したマウス(Mafb欠損マウス)に腎虚血再灌流障害モデルにより虚血性急性腎障害を誘導したところ、野生型のマウスに比べ、生存率の低下や、血清尿素窒素(BUN)、クレアチニン値の増加などの予後の悪化を示した。また、虚血性急性腎障害を誘導すると、MAFB陽性のマクロファージが腎臓内で増加した。
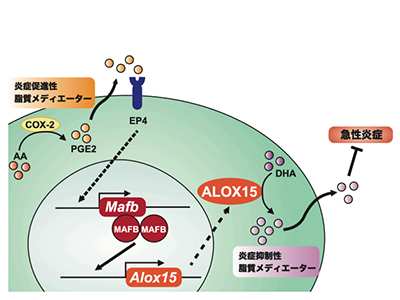
MAFB、COX-2/PGE2/EP4経路下でのみ炎症抑制に働くALOX15発現を誘導
マクロファージに発現するMAFBがどのようなメカニズムで急性腎障害を緩和するのかを解明するため、これらのマウスでのマクロファージの遺伝子発現をRNA-seqにより網羅的に解析した。その結果、Mafb欠損マウスのマクロファージでは、Alox15遺伝子の発現が顕著に減少。免疫染色でマクロファージを検出すると、mRNAに加え、タンパク質レベルでもMafb欠損マウスでのALOX15陽性マクロファージ数の減少が確認された。ALOX15はドコサヘキサエン酸(DHA)などの必須脂肪酸を代謝することで、炎症抑制性の脂質メディエーターを産生する。
また、急性腎障害を誘導した腎臓に浸潤したマクロファージでは、MAFBの発現は、炎症性の酵素COX-2が必須脂肪酸であるアラキドン酸(AA)を代謝することにより産生されるPGE2がEP4受容体を活性化することで誘導される。培養マクロファージを用いたin vitro解析により、MAFBはこのCOX-2/PGE2/EP4経路下でのみ、ALOX15の発現を制御することがわかった。PGE2は炎症促進性の脂質メディエーターであると同時に、炎症抑制性脂質メディエーターへの脂質メディエータークラス転換を媒介することが知られている。
MAFB、急性腎障害で脂質メディエーターのクラス転換に不可欠
以上のことから、急性腎障害において、マクロファージに発現するMAFBは、ALOX15の発現を制御することにより、PGE2による炎症促進性脂質メディエーターから炎症抑制性脂質メディエーターへのクラス転換において必須の役割を果たすことが明らかとなった。
今回の研究により、マクロファージに発現する転写因子MAFBが、急性腎障害において脂質メディエーターのクラス転換に不可欠であることが明らかとなった。炎症促進性と炎症抑制性の脂質メディエーターのバランスは急性炎症の予後に非常に大きな影響を及ぼすことから、同研究成果は、急性腎障害だけでなく、さまざまな急性炎症性疾患の治療法や診断法の開発につながることが期待される、と研究グループは述べている。
▼関連リンク
・筑波大学 TSUKUBA JOURNAL




