主要な死因の一つである心不全、より安価で簡便な治療法開発が求められている
東京大学医学部附属病院は7月12日、心不全モデルマウスを用いて、世界で初めて心不全ワクチンの開発に成功したと発表した。この研究は、同大大学院医学系研究科先端循環器医科学講座の加藤愛巳特任助教、野村征太郎特任准教授、小室一成特任教授、先端科学技術研究センターゲノムサイエンス&メディシン分野の油谷浩幸シニアリサーチフェロー(東京大学名誉教授)、大阪大学大学院医学系研究科健康発達医学寄附講座の中神啓徳寄附講座教授らの研究グループによるもの。研究成果は、「Circulation」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
心不全は、多因子疾患であり予後不良の疾患である。現時点では心臓移植以外に根治的治療法は存在しない。発症すると労作時呼吸困難などから始まり、進行すると安静時呼吸困難、起座呼吸となり著しく生活の質が低下する。心臓の機能が低下すると、心臓内に血栓が生じるリスクや、致死的な不整脈の発生リスクが生じ、非常に危険な状態となる。心不全の原因はいまだ不明で、根本的な治療法開発も進んでいないのが現状である。唯一の治療法である心臓移植の待機期間は、日本では2〜5年と長く、仮に移植を行えたとしても、生涯にわたる免疫抑制薬の服用、感染予防の徹底など、患者は大きな負担を強いられる。心不全に対する原因究明と新たな治療法開発は喫緊の課題となっている。さらに、心不全は世界的にも主要な死因の一つであり、より広範囲での治療を可能にする必要があるため、安価で簡便な治療法の開発が求められている。
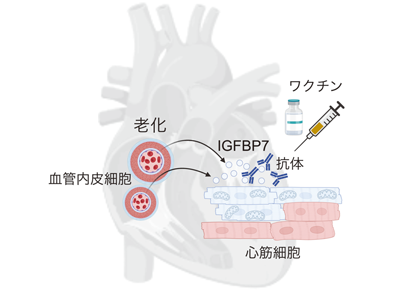
心不全モデルマウスのシングルセル解析でIGFBP7遺伝子高発現の細胞集団同定
研究グループは、心不全の病態を解明するために、心不全モデルマウスを用いて、心筋細胞と非心筋細胞の同時single cell RNA-seq(単一細胞遺伝子発現解析)を行った。その結果、心不全状態の内皮細胞において、IGFBP7遺伝子を高発現している細胞集団を同定した。また、この細胞集団は老化細胞集団であることも示した。
老化内皮細胞から分泌のIGFBP7、心筋細胞のミトコンドリア機能を抑制
さらに、同一個体から取得した心筋細胞のsingle cell RNA-seqデータ解析、メタボローム解析、iPS心筋細胞の解析、といった種々の結果によって、内皮細胞から分泌されたIGFBP7が心筋細胞の酸化的リン酸化を抑制することで、ミトコンドリアが機能不全へと陥ることがわかった。このことから、心不全の病態として、老化した内皮細胞から分泌されたIGFBP7が細胞間相互作用で心筋細胞のミトコンドリア機能を抑制することで心不全を誘発するという、新たな知見を得ることができた。
IGFBP7に対するワクチン開発、心不全モデルマウスで治療効果確認
研究グループは、IGFBP7に対するワクチンを開発し、ワクチン投与によって、心不全モデルマウスの心機能を改善させることに成功した。
今回の研究によって、世界で初めて、ワクチンによる心不全治療の可能性が示された。ワクチンは、安価で製造でき、接種も容易なうえ、副作用が比較的少ないことが知られている。心不全は世界的に主要な死因の一つであり、ワクチンのような汎用性の高い治療法があれば、より多くの心不全患者に治療を提供することができる。またワクチンは、心不全の発症リスクが高い患者に対して早期に接種することで、心不全を予防する手段にもなり得る。
「今後、さらにワクチン開発を進めることで、世界中の多くの心不全患者の役に立つことが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




