多くの疾患の発症に関わるエンハンサー、1細胞レベルでの解析は少ない
理化学研究所(理研)は7月5日、ヒトの多様なヘルパーT細胞の遺伝子プロモーターやエンハンサーを1細胞レベルで調べることに成功し、多様なヘルパーT細胞がさまざまな免疫疾患の発症にどのように関与するのかを系統的に解明したと発表した。この研究は、理研生命医科学研究センター理研-IFOMがんゲノミクス連携研究チームの小口綾貴子リサーチアソシエイト(京都大学高等研究院ヒト生物学高等研究拠点WPI-ASHBi特任研究員)、小松秀一郎客員研究員、村川泰裕チームリーダー(京都大学高等研究院ヒト生物学高等研究拠点WPI-ASHBi教授)、自己免疫疾患研究チームの鈴木亜香里上級研究員、山本一彦チームリーダー(生命医科学研究センターセンター長)、ゲノム解析応用研究チームの寺尾知可史チームリーダーらの研究グループによるもの。研究成果は、「Science」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、大規模な疾患ゲノム解析が国際的に行われ、疾患発症に関わる遺伝的変異が多く見つけられている。これらの多くは、タンパク質をコードしないノンコーディング領域に位置しており、その領域の中でも特に、遺伝子発現のスイッチの構成要素であるエンハンサーにあることがわかってきた。しかし、ヒトゲノムにどれだけのエンハンサーが存在するかも、エンハンサーの機能的意義も、まだ十分に解明されていない段階である。
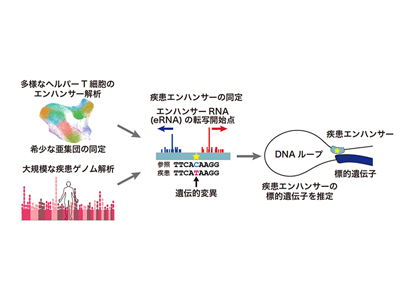
エンハンサーは、遺伝子遠方にあるDNA配列で、細胞種ごとに特異的に標的の遺伝子を活性化する。エンハンサーが活性化すると、その両端からエンハンサーRNAが合成される。このエンハンサーに遺伝的変異が生じると、その標的とする遺伝子の「質」ではなく「量」が変化する。それが疾患の発症に関わることが最近の研究でわかってきている。理研が中心となり結成されたFANTOMコンソーシアムでは、エンハンサーRNAをヒトのさまざまな細胞・組織で解析し、エンハンサーの研究において世界をリードしてきた。しかし、これまでのRNA解析技術の限界から、1細胞レベルでの解析は十分に行えていなかった。
免疫疾患発症に深く関与するヘルパーT細胞、活性化するエンハンサーに着目
ヘルパーT細胞は、免疫の司令塔としていろいろな機能を持っており、自己免疫疾患やアレルギー疾患に深く関与している。ヘルパーT細胞には、Th1やTh2などさまざまな亜集団が存在しており、それぞれが異なる役割を担っている。ヘルパーT細胞の多様性を1細胞レベルで詳細に解き明かし、多様なヘルパーT細胞で活性化しているエンハンサーを網羅的に同定できれば、免疫疾患発症の遺伝的メカニズムの理解が深まることが期待される。
ReapTEC法、1細胞レベルで転写開始点・プロモーター・エンハンサー活性を同時解析
研究グループは、RNAの先頭に付加されたキャップ構造に由来するシグナルを高精度に捉える情報処理の手法に工夫をして、1細胞レベルでRNAの転写開始点を同定し、プロモーターとエンハンサーの活性を同時に解析できる独自の手法論、1細胞エンハンサー解析法(ReapTEC法)を開発した。
6万か所以上のヘルパーT細胞活性化エンハンサー同定、亜集団ごとの活性地図も作成
ReapTEC法を、ヒトから採取した約100万個のヘルパーT細胞に適用することで、それぞれのヘルパーT細胞において、ダイナミックに変化しているRNAの転写開始点を同定してRNAの発現量を計測した。その結果、報告されていない希少な亜集団を発見し、ヘルパーT細胞の多様性を見つけた上、それぞれのヘルパーT細胞の亜集団で活性化している遺伝子プロモーターおよびエンハンサーを網羅的に同定した。その上で合計6万か所を超えるヘルパーT細胞で活性化しているエンハンサーを同定し、ヘルパーT細胞の亜集団ごとのエンハンサー活性地図を作成した。
免疫疾患に関連した遺伝的変異を持つヘルパーT細胞エンハンサーを600か所同定
次に、ある特定の免疫疾患に関連した遺伝的変異が、ヘルパーT細胞のどの亜集団のエンハンサーに存在しているのかを解析した。
大規模なゲノムワイド関連解析によりいろいろな自己免疫疾患やアレルギー疾患に関連する遺伝的変異が数百か所以上同定されている。こうした免疫疾患に関連した遺伝的変異の部位と、今回得られた多様なヘルパーT細胞で活性化しているエンハンサー領域を重ね合わせる解析を行った。まず、ヘルパーT細胞のエンハンサー領域には、全体としても、自己免疫疾患やアレルギー疾患に関連する遺伝的変異が強く濃縮していることが示された。また、免疫疾患に関連した遺伝的変異を持つヘルパーT細胞エンハンサー(疾患エンハンサー)を合計で約600か所同定した。
Micro-C法でゲノムの3次元構造解析、疾患発症に至る分子経路や疾患関連分子同定
さらに、疾患エンハンサーの標的遺伝子を同定することで、疾患発症の関連分子を解析した。エンハンサーは標的とする遺伝子に空間的に近接して働きかける。そこで、研究グループは、ゲノムの3次元構造をヌクレオソームレベルの高い塩基解像度で決定することができるMicro-C法を行った。過去に前例のない深達度のMicro-CデータをヘルパーT細胞で作成して、どのゲノム領域が物理的に近接しているのかを解析した。これにより、それぞれの疾患エンハンサーの標的遺伝子を推定した。そして、自己免疫疾患やアレルギー疾患がどのような分子経路で発症に至るかを疾患系統的に解析し、新しい疾患関連分子を数多く同定した。
免疫疾患の分子メカニズム理解や新しい治療標的分子発見につながると期待
自己免疫疾患やアレルギー疾患の多くは、どのような分子メカニズムで発症するのか十分にわかっておらず、治療が困難な場合も多くある。この研究では、免疫疾患発症に関わる分子を疾患横断的に解析することに成功した。その結果、既知の分子だけでなく、新規の分子を数多く見つけた。これにより、免疫疾患が発症する詳細な分子メカニズムの理解が加速的に進み、新しい治療標的分子が見出されることが期待される。
さらに、1細胞レベルで多様なヘルパーT細胞を解析し、これまで報告されていない新しい亜集団を数多く同定した。こうした新規のヘルパーT細胞の発見により、新しい免疫システムの理解、さらには新しいがん免疫療法の開発につながる可能性がある。
今回の研究では、独自の1細胞解析法を開発し、ヘルパーT細胞の多様性を解きながら、自己免疫疾患やアレルギー疾患の理解に役立てた。「同様のアプローチは、生活習慣病、心血管疾患、精神疾患などに応用することができ、今後いろいろな疾患に対して、新しい革新的医療を創出することが期待される」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



