MSの一部が移行の二次性進行型、病態進行を止める治療法は未確立
九州大学は6月25日、二次性進行型多発性硬化症(MS)の病態の一部が脳内グリア細胞の異常活性化とその拡散であることを突き止め、アストログリア細胞が発現するギャップ結合タンパク質コネキシンの作用を薬理学的にブロックすることにより、グリア細胞からの炎症反応を抑制するメカニズムを発見したと発表した。この研究は、同大医学研究院神経内科学分野の山﨑亮准教授、大学院医学系学府博士課程の高瀬・E・オズデミル氏、国際医療福祉大学医学部の竹内英之教授らの研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
MSは、若年女性に多い中枢神経系の自己免疫性脱髄疾患で、多くは発症初期に再発・寛解を繰り返す「再発寛解型MS」の経過をとるが、一部の症例で経過中に再発によらない病状の進行を呈する「二次性進行型MS」に移行する。従来は欧米に多い疾患だったが、食生活の多様化やグローバリゼーションなどにより日本でも患者数は増加傾向にある。世界で約300万人の患者がおり、日本でも2万人を超える患者がいると考えられている。
再発寛解型MSは末梢血由来の自己反応性免疫細胞が主に病態に関わると考えられ、各種疾患修飾薬による免疫抑制・調整治療が行われている。一方、二次性進行型MSにおける病態進行の仕組みについてはこれまで十分にわかっておらず、完全に病態進行を止める治療法はいまだ開発されていない。
二次性進行型MS患者の脳幹病変部にコネキシンの過剰発現を発見
MS患者は、脳脊髄に多発性病変を生じ、活動性の病変部は造影される。MSの病変部では、脳脊髄の神経を被覆している髄鞘(ミエリン)に対する自己免疫反応により髄鞘が破壊され(脱髄)、神経伝導の障害を来す。脱髄を繰り返したり、脱髄が遷延したりすると、露出した神経線維自体にも障害がおよび、不可逆的障害を来すこともある。
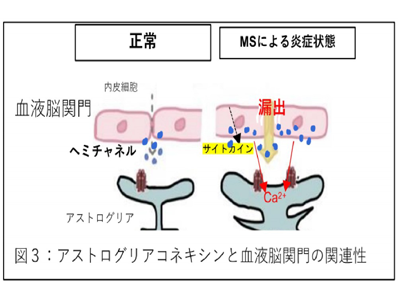
研究グループは、二次性進行型MS患者の脳幹病変部で、アストログリアという脳細胞同士をつなぐギャップ結合タンパク質コネキシンが過剰発現していることを見出した。コネキシンは膜貫通タンパク質で、6つのコネキシンを結合させてギャップ結合を形成する。イオンとカルシウムの輸送を促進し、細胞間のコミュニケーションを維持する役割を持っている。
このタンパク質は細胞表面でヘミチャンネル(物質を細胞内外でやりとりする門)を形成することもわかっており、この過剰発現が二次性進行型MSの病態と関係していると考えた。
活性化アストログリアでコネキシン発現増加、ヘミチャンネル介し炎症性物質拡散
二次性進行型MSにおけるアストログリアの活性化は、炎症性サイトカインの分泌、アデノシン5′-三リン酸(ATP)に対する反応性の増加、受容体からのCa2+流入の増加の免疫効果機序を引き起こす。このアストログリアの活性化は主に脳を守るバリアである血液脳関門を破壊し、脳および脊髄への炎症細胞の浸潤を可能にし、病変拡大や組織障害の遷延化につながる。さらに、活性化したアストログリアはギャップ結合タンパク質コネキシンの発現が増加し、コネキシンヘミチャンネルを介して活性化アストログリアからの炎症性物質の拡散をもたらす。これらの炎症性物質は、ミクログリアなど周囲のグリア細胞活性化を引き起こし、グリア炎症が拡大・遷延化する。
モデルマウスの脱髄病変、汎コネキシン阻害薬により病状改善
この研究で、多発性硬化症モデルマウスの脱髄病変で過剰発現したアストログリアコネキシン・ヘミチャネルを汎コネキシン阻害薬(INI-0602)で遮断した結果、病状が改善し、中枢神経系への炎症性細胞の浸潤が減少し、脊髄の脱髄が抑制された。
「本治療薬は、二次性進行型MSの動物モデルで高い治療効果を認め、実際の二次性進行型MS患者でも有効であることが期待される」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果




