非アルコール性脂肪肝炎(NASH)と呼ばれていたMASH
横浜市立大学は6月12日、Metabolic dysfunction-associated steatohepatitis(MASH)患者を対象に、GIP(グルコース依存性インスリン分泌刺激ポリペプチド)とGLP-1(グルカゴン様ペプチド‐1)の2つのインクレチン作用を持つチルゼパチドの有効性を検討する、国際共同第2相プラセボ対照無作為化比較試験の結果を発表した。この研究は、同大附属病院国際臨床肝疾患センター米田正人センター長(同医学部肝胆膵消化器病学准教授)が参加するSYNERGY-NASH Investigatorsグループの研究グループによるもの。研究成果は、「The New England Journal of Medicine」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
MASHは、2023年6月より非アルコール性脂肪肝炎(NASH)と呼ばれていた病態が国際的に病名変更されたもの。邦訳の正式名は現在検討中だ。MASHの薬物治療効果については、GLP-1の48~72週の第2相試験が行われていた。これらの試験では、GLP-1投与によるMASHの組織学的改善は得られていたが、線維化改善効果は認められていなかった。一方で、チルゼパチドは、GIPと、GLP-1の2つの受容体に作用する持続性GIP/GLP-1受容体作動薬であり、日本では2型糖尿病治療、海外では2型糖尿病や肥満治療に使用されている。
チルゼパチド、MASHへの安全性・有効性評価のランダム化二重盲検プラセボ対照P2試験
今回、ランダム化二重盲検プラセボ対照第2相試験として、MASH患者に対するチルゼパチドの安全性や有効性を調べる試験が10か国130施設で実施された(SYNERGY-NASH trial)。対象は生検によりMASHが確定し、BMIが27~50kg/m2の18~80歳の患者で、2型糖尿病の有無は問わなかった。組織学的にMASHが確定している(NAFLD activity score 4点以上、各サブコンポーネント[肝脂肪化、肝細胞の風船様変性、炎症]のスコアが1以上)、線維化F2もしくはF3の患者を対象とした(F0:線維化なし、F1:軽度、F2:中等度、F3:重度、F4:肝硬変)。190人のMASH患者は、チルゼパチド5mg(n=47)、10mg(n=47)、15mg(n=48)、プラセボ群(n=48)に1:1:1:1の比率でランダムに割り付けがされた。
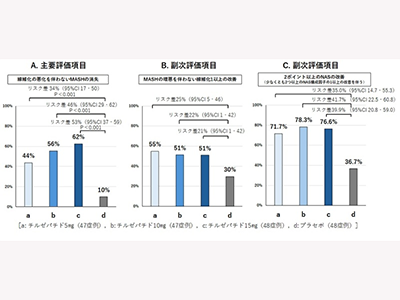
線維化悪化を伴わないMASHの消失など、有意な改善効果
同試験の結果、主要評価項目「線維化悪化を伴わないMASHの消失」は、チルゼパチド5mg、10mg、15mg群でそれぞれ44%、56%、62%(プラセボ群は10%)となり、すべての容量のチルゼパチドでプラセボ群と比べ、統計的に有意な改善効果を認めた(いずれの群もプラセボ群と比較しP<0.001)。
副次評価項目「MASHの増悪を伴わない線維化1ステージ以上の改善」は、チルゼパチド5mg、10mg、15mg群でそれぞれ55%、51%、51%(プラセボ群は30%)であり、すべての容量のチルゼパチドでプ改善効果を認めた。
副次評価項目の1つ「NAS 2ポイント以上の改善(少なくとも2つ以上のNAS構成因子の1以上の改善を伴う)」は、チルゼパチド5mg、10mg、15mg群でそれぞれ71.7%、78.3%、76.6%(プラセボ群は36.7%)となり、すべての容量のチルゼパチドでプラセボ群と比べ改善効果が認められた。
体重減少は、チルゼパチド5mg、10mg、15mg群でそれぞれ-10.7%、-13.3%、-15.6%であり、いずれの群もプラセボ群の-0.8%と比較して減量効果が認められた。なお、同試験におけるチルゼパチドの主たる副作用は胃腸障害だった。
チルゼパチド長期投与によるMASHの肝線維化持続的改善効果の検証など、P3試験に期待
今回の第2相臨床試験結果により、線維化F2/F3を伴うMASH患者に対するチルゼパチドの安全性と有効性が証明された。今後、チルゼパチド長期投与によるMASHの肝線維化の持続的改善効果や、肝重症有害事象(major adverse liver outcomes:MALO)の抑制効果、また、MASH肝硬変患者に対する安全性や有効性を評価する第3相試験が期待される、と研究グループは述べている。
▼関連リンク
・横浜市立大学 プレスリリース




