宇宙滞在で体の深部組織で起こる変化を「リキッドバイオプシー」解析で検証
筑波大学は6月12日、宇宙滞在中に体の深部組織で起こる変化を、血液検体から網羅的に予測することに成功したと発表した。この研究は、同大医学医療系の村谷匡史教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
宇宙の微小重力環境では、筋萎縮や骨量減少といった生体の抗重力機能の減退が急速に起こることが知られており、月や火星を目指す有人宇宙探査に向けて克服すべき重要な課題となっている。このため、国際宇宙ステーション(ISS)の日本の実験モジュール「きぼう」に設置されている人工重力装置やマウス飼育装置では、さまざまな研究が行われ、骨や筋組織が宇宙で受ける変化の分子機構が明らかになっている。その一方で、モデル動物を用いた研究により、体内時計や代謝の変化などが起こることも、新たにわかってきており、ヒトでもさまざまな器官・組織を網羅的に解析し、同様の応答が起こるのかを検証する必要性が認識されるようになった。しかし、宇宙飛行士の体内深部の組織を直接調べることは容易ではない。
「リキッドバイオプシー」とは、血液などの液性検体を採取し、その中の細胞外小胞に含まれる生体分子を解析し、体内深部の組織や細胞で起こる変化を捉える解析技術で、採血だけで体内の変化を捉えることができるため、臨床検査への応用でも注目されている。
そこで研究グループは今回、宇宙飛行士を対象に、打ち上げ前、宇宙滞在中、帰還後に採取した血液検体を用いてリキッドバイオプシー解析を行い、ヒトにおける宇宙環境応答の統合的な評価を行った。
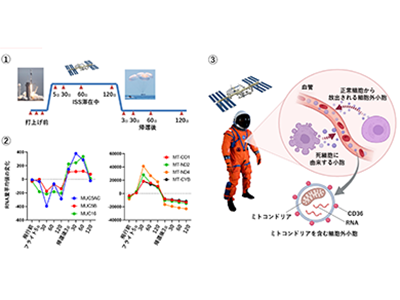
6人の宇宙飛行士を対象に、飛行前後とISS滞在中に血液を11回採取
研究では6人の宇宙飛行士を対象に、飛行前後とISS滞在中に計11回、血液を採取した。その血漿部分に含まれる細胞外DNAやRNA(セルフリーDNA、RNA)を解析し、宇宙で変化する遺伝子を同定した。これらの遺伝子の中には特定の臓器や組織で働くことが知られているものがあり、この情報をもとに宇宙環境に応答する臓器や組織の種類を推定することができる。
宇宙で血漿中に放出されるミトコンドリア、地上とは遺伝子の制御が異なると判明
このうち、特に顕著な変化が見られた細胞外ミトコンドリアをより詳細に解析するため、361種類の候補タンパク質を調べ、CD36と呼ばれる細胞表面タンパク質が細胞外ミトコンドリアを分離する指標(マーカー)として有効であることを見出した。CD36に対する抗体を用いて、宇宙で血漿中に放出されるミトコンドリアを含む細胞外小胞を単離して解析した結果、その由来組織として、脳、眼、心臓、血管系、肺や皮膚などを同定することに成功した。さらに、宇宙で血漿中に放出されるミトコンドリアには、地上とは遺伝子の制御が異なっている特徴があることが判明した。
ヒトで見られるミトコンドリアの変化には、重力変化の要因が特に関与の可能性
また同研究で、JAXA(宇宙航空研究開発機構)が2016年に行った宇宙でのマウス飼育研究の際の血液検体を用いて同様の解析を行ったところ、マウスでもヒトと同様のミトコンドリアの変化が起こっていることが明らかになった。宇宙環境には、無重力、宇宙放射線、その他の船内環境などさまざまな要因が含まれるが、マウスの研究結果との比較から、ヒトで見られるミトコンドリアの変化には、とりわけ重力変化の要因が関係していることが示唆された。
地上と宇宙における医学研究の相互進展に期待
細胞外へのミトコンドリアの放出は、神経組織の炎症や代謝関連疾患などに関わることが報告されており、宇宙で起こる変化と地上での疾患の関連を調べることで、地上と宇宙の医学研究の相互の進展が期待される。また、表面タンパク質を指標とした血漿中の細胞外小胞を分離する技術は、リキッドバイオプシー解析の高精度化につながり得るものだ。
「さらに機械学習や人工知能を応用したデータ解析技術と組み合わせることで、全身のさまざまな細胞の遺伝子変化を血液検体から予測することが可能になると考えられる」と、研究グループは述べている。
▼関連リンク
・筑波大学 TSUKUBA JOURNAL




