抗PD-1抗体無効例に対する有効で安全な治療法が待ち望まれていた
東北大学は6月7日、同大で開発した新規医薬品「PAI-1阻害薬 TM5614」がメラノーマにおいて、免疫チェックポイント分子発現を阻害して抗腫瘍免疫を増強することを発見したと発表した。この研究は、同大大学院医学系研究科皮膚科学分野の藤村卓准教授らの研究グループによるもの。研究成果は、「British Journal of Dermatology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
悪性黒色腫は臨床症状と病理所見より表在拡大型、末端黒子型、悪性黒子型、結節型の4病型に分類されている。欧米では比率が2%程度の末端黒子型が、日本では40%を占めている。
免疫チェックポイント阻害薬は、抗PD-1抗体のオプジーボとキイトルーダ、およびオプジーボ+ヤーボイ併用の3種類が一次治療で使用されている。しかし、日本に多い末端黒子型は表在拡大型に比べて体細胞変異数が少ないため、抗PD-1抗体が奏効しづらいとされる。実臨床においても、国内の悪性黒色腫一次治療としての抗PD-1抗体の奏効率は16~22%、オプジーボ+ヤーボイ併用は41%であり、欧米の38~44%、58%と比較すると極めて低く、抗PD-1抗体の無効例が日本では欧米より多いとされる。一方、オプジーボのgrade3以上の有害事象は12.5%、オプジーボ+ヤーボイ併用は59%となっている。日本人において抗PD-1抗体無効例では、オプジーボ+ヤーボイ併用療法の有効性は10〜20%であり、入院が必要な有害事象が60%以上の患者に発症している。
抗PD-1抗体無効例に対する標準治療は、現在はオプジーボ+ヤーボイ併用もしくはヤーボイ単剤が使用されている。しかし、日本人での有効性はそれぞれ13.5%、3.6%と低く、それゆえ、抗PD-1抗体無効例に対する有効で安全な治療法が待ち望まれていた。
抗PD-1抗体無効進行期メラノーマ患者で、オプジーボ+TM5614の有効性を検討
研究グループは、全国7医療施設(東北大学、筑波大学、都立駒込病院、がん研有明病院、名古屋市立大学、近畿大学、熊本大学)による多施設共同研究として、2021年9月~2023年3月に、抗PD-1抗体無効の進行期メラノーマ34例に対し、オプジーボとPAI-1阻害薬TM5614の安全性・有効性を検討する医師主導治験(第2相試験)を施行した。
TM5614が免疫チェックポイント分子発現を阻害し、抗腫瘍免疫を増強
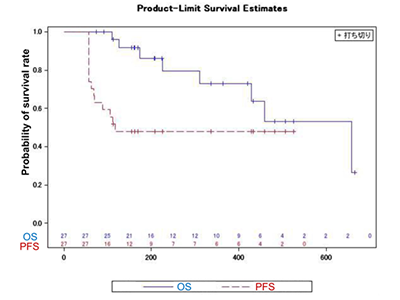
その結果、治療期間終了時点で27人がprotocol per set(PPS)解析の対象となった。オプジーボとTM5614の併用期間が8週間という短期間であるにも関わらず、主要評価項目である奏効率は25.9%であり、開始当初の設定期待奏効率の20.0%を大きく上回った。
また、副次評価項目である安全性では薬剤と因果関係の否定できない重度有害事象の発症率は7.7%であり、標準治療であるオプジーボ+ヤーボイ併用(55-70%)もしくはヤーボイ単剤療法(55-70%)と比較して大幅に減少していた。併用期間が56日間のみであるにも関わらず、探索的項目である無増悪生存期間は174日(95% CI:114.4–232.9)と、がんの進行が併用療法終了後約 4か月間停止しており、メラノーマ治療の中心的薬剤である抗 PD-1 抗体が再び効果を持ち始めたことが示された。
薬事承認を目標に、2025年より第3相試験を開始予定
併用期間の延長により、さらなる無増悪生存期間の改善が期待される。なお、薬事承認と商業化を目指し、2025年2月より、検証的第3相試験(医師主導治験)を開始する予定だ。今後は日本における悪性黒色腫患者の生存期間の向上につながることが期待される、と研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース




