PD進行に伴い線維化aSynが正常内因性aSynを凝集させる
東京医科歯科大学は6月7日、αシヌクレイン(aSyn)をコードするマウスSnca遺伝子を標的としたASOを、パーキンソン病異常病理進展動物モデルマウスの脳に局所投与することで、投与条件に応じた病理発現予防および進展抑制効果を示したと発表した。この研究は、同大大学院医歯学総合研究科脳神経病態学分野(脳神経内科)の横田隆徳教授、同大統合研究機構先端医歯工学創成クラスター核酸・ペプチド創薬治療研究センターの永田哲也教授、佐野達彦大学院生、東京都医学総合研究所脳・神経科学研究分野の長谷川成人分野長・認知症プロジェクトリーダーらの研究グループによるもの。研究成果は、「Acta Neuropathologica Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
aSynはパーキンソン病(PD)などの神経変性疾患で細胞の脱落との関係が示唆されている。PD患者脳でaSynは神経細胞体に存在するレビー小体(LB)および神経突起に存在するレビー神経突起(LN)と呼ばれる異常線維構造として沈着し、病的なリン酸化(pSyn)を含む修飾を受け、生化学的にはサルコシル不溶性が認められる。PD患者脳ではaSyn病理は嗅球および脳幹から出現し病期の進行に伴い他の脳領域へと広がることが示唆されている。また、培養細胞や動物を用いた実験から、線維化aSynが正常な内因性aSynを凝集させることが証明されている。これらの事実からaSynのプリオン様病理伝播機序が想定され、主に神経回路を介した進展が示唆されている。内因性のaSyn産生を減少させることがPDや他のaSyn病の患者の治療戦略として考えられる。
線維化aSyn線条体接種マウスにaSyn標的ASO治療実施、病期に応じた治療効果を評価
ASOは細胞内で標的mRNAの分解を特異的に誘導し、対応するタンパク質を減少させる。aSynをコードするSnca mRNAを標的としたASO治療は、PD動物モデルにおける側脳室注射により脳全体のaSynの減少が病理伝播を予防・抑制することが示されている。
研究グループはSnca ASOの病期に応じた治療効果を評価するために線維化aSyn線条体接種モデルマウスを用いて、ASOの投与時期と部位ごとに、aSyn病理の細胞内および神経回路を介した異常aSyn病理伝播に対する予防・進行抑制効果を調べた。
野生型マウスへのASO局所投与で脳部位限定的な発現抑制を確認
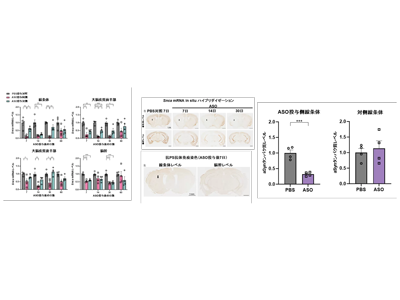
最初に、野生型マウス脳の左線条体へのASO投与によるSnca遺伝子の発現抑制効果を評価した。ASO 300μg投与によりSnca mRNAの抑制効果は、注射部位である左線条体で87%に達し、反対側である右線条体では39%と左右差を認め、その抑制効果は大脳皮質でも観察され、投与部側優位な抑制効果は30日以上持続した。Snca mRNAに対するISHも結果はqRT-PCRの結果と一致した。抗PS抗体による免疫染色では、ASOは注射側に優位に分布しており、観察されたSnca mRNAの抑制効果と一致した。ISHと抗PS抗体免疫染色から得られた結果から、ASOは主に受動拡散によって分布することが想定された。aSynタンパク質の減少を確認するため、ASO注射の14日後に脳で免疫ブロッティングを行った。ASO投与部位の左線条体では約68%の減少が認められたが、右側の脳ではaSynの減少は観察されず、局所投与による脳部位限定的な抑制が達成された。
線維化aSyn接種前のASO投与、広範な脳領域での病理出現予防効果示す
aSyn凝集開始前のASO投与によるaSyn病態予防効果を評価するため、マウス脳の左線条体に線維化aSynを接種する14日前に同部位にASOを投与する条件で評価を行った。PBS前投与群ではpSynの免疫染色により、一部の神経細胞ではLBと同様に、細胞体に陽性となる封入体を認めた。また、一部の神経細胞では封入体が神経突起に観察され、LNに類似していた。どちらのタイプの封入体も、細胞内封入体の特徴であるユビキチンとp62染色で陽性だった。また、Campbell-Switzer銀染色は陽性で、Gallyas-Braak銀染色は陰性であり、PD患者のLBやLNと同じ性質を示した。
この「細胞体」と「神経突起」病理を指標としてpSyn陽性となる神経細胞密度を複数の脳領域で比較した。Snca ASO群では、PBS群と比較して、左線条体で細胞体(95%)および神経突起(92%)陽性細胞密度減少が認められ、広範な脳領域での病理出現予防効果を認めた。また、免疫ブロット法でASO群ではサルコシル不溶性pSynの減少(93%)が示された。ユビキチンとp62の免疫染色でも、Snca ASO群で陽性細胞密度の減少が認められた。ASO投与による細胞毒性や運動機能障害は認められなかった。
線維化aSyn接種後のASO投与、投与側の運動皮質・扁桃体などで進行抑制効果
次にaSyn凝集開始後のASO投与のaSyn病態進行抑制効果を評価するために、マウス脳の左線条体への線維化aSyn接種と同時、または7、14日後にASOを投与する条件で評価を行った。ASO同時投与群では、線維化aSyn単独投与群と比較して、左線条体での細胞体(96%)および神経突起(70%)pSyn陽性細胞密度が減少し、同側の運動皮質、扁桃体などでの進行抑制効果を示した。一方で7、14日後のASO投与群では、細胞体病理の減少は認めたが神経突起病理の減少は観察されなかった。細胞体病理と一致して、サルコシル不溶性pSynはASO同時投与群(98%)および後投与群(83%および90%)のいずれも減少効果が認められた。
最後にaSyn凝集開始部位から遠隔の脳領域でのASO投与によるaSyn病態進行抑制効果を評価するために、マウス脳の左線条体に線維化aSynを接種する14日前に反対側である右線条体にASOを投与する条件で評価を行った。pSyn免疫染色でASO投与部位近傍の右線条体、右運動皮質において、pSyn陽性密度の減少を認めた。ASOを注射した同側の大脳皮質前半分のサルコシル不溶性pSynの減少傾向が認められた。
内因性aSynを完全枯渇させず減少のASO治療、高い安全性・有効性に期待
研究グループはSnca ASOの脳内局所投与により、その近傍に限定的な内因性aSynの発現抑制を達成した。PD患者類似のaSyn病理伝播モデルマウスにおいて、線維化aSyn接種部位である左線条体へのASO注射は内因性aSynを完全に抑制することなく、時間依存的に同部位および神経接続を有する広範な脳領域でのpSyn病理進展を予防または進行抑制し、他の関連病理も減少させた。また、生体内で初めて内因性aSynの発現抑制による神経突起から細胞体への病理進展の抑制を証明し、その一部が可逆的であることを示した。生化学的には不溶性pSynの減少を認めた。これらの結果から、線維化aSynによって誘導されるpSyn病理の開始と細胞内伝播には、一定量の内因性aSynが必要である可能性を示した。さらに線維化aSyn接種部位から遠隔領域でのASO投与で投与部位での病理進行抑制効果を示した。このことから、パーキンソン病(孤発性および家族性)、レビー小体型認知症、多系統萎縮症などのシヌクレイノパチーの患者に対して、ASOで内因性aSynを完全に枯渇させることなく減少させることで治療可能であることを示した。加えて、さまざまな病期に応じた治療応用が可能であることを示している。
「現在、シヌクレイノパチーに対してaSynを標的とした抗体医薬品やワクチンが開発中だが、その効果は細胞内の病理進展には及ばない可能性があり、核酸医薬により細胞内の正常aSynを限定的に制御することで、本来の生理的な機能を保ちつつ病原性aSynの伝播を抑制できる可能性があり、より高い安全性、有効性が期待できると考えられる」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




