肝細胞脱分化の動態やメカニズム、肝細胞から脱分化した細胞の分化能を検証
九州大学は5月16日、培養下における肝細胞脱分化の実態とそのメカニズムの解明、並びに肝細胞が腸上皮細胞への分化能を有することを発見したと発表した。この研究は、同大生体防御医学研究所の鈴木淳史教授、三浦静助教らの研究グループと、同研究所の大川恭行教授との共同研究によるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
肝細胞は肝臓の80%近くを占め、代謝、胆汁の生成と分泌、薬物の解毒、グリコーゲンの貯蔵、タンパク質の合成など、幅広い機能を有している。初代培養肝細胞のユニークな特徴として、単層培養下では急速にその機能特性を失い、肝前駆細胞様の細胞へと脱分化することが知られている。肝細胞は脱分化後に高い増殖能を獲得するため、それら大量の細胞を用いた肝疾患の治療戦略が考えられる。しかし、脱分化した肝細胞の細胞動態、脱分化状態の誘導と維持のメカニズム、脱分化細胞の分化能についてはまだ多くの研究が必要と言える。
胎生期の肝臓では、肝前駆細胞(肝芽細胞とも呼ばれる)が増殖し、肝細胞と胆管上皮細胞の両方を生み出して肝臓組織を形成する。一方、成体の肝前駆細胞(オーバル細胞とも呼ばれる)は、重篤な肝障害に応答して出現し、増殖して肝細胞と胆管上皮細胞の両方に分化し、損傷した肝臓組織を再生させることができる。研究グループは以前、胎生期のマウス肝臓と慢性的に重い傷害を受けた成体マウス肝臓から、それぞれ肝芽細胞とオーバル細胞を特異的に分離・回収することに成功していた。その際に用いた培養系では肝芽細胞とオーバル細胞を1つずつ別々の培養皿で培養し、個々の細胞を長期間、安定的に増殖・維持させることが可能だった。これらのデータから、肝芽細胞やオーバル細胞を効率よく増殖させる培養条件は、肝前駆細胞の培養に適していることが示唆された。
そこで今回の研究では、肝前駆細胞用に確立した当該培養系を用いて成体マウス肝細胞を培養し、肝細胞脱分化の動態やメカニズム、並びに肝細胞から脱分化した細胞の分化能について検証を行った。
マウス肝細胞が、高い増殖能をもつ肝前駆細胞様の細胞へ脱分化することを確認
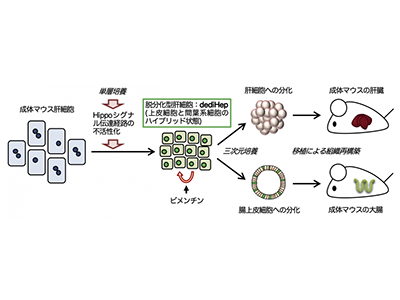
確立した肝前駆細胞用の培養系を用いて成体マウス肝細胞を培養した結果、高い増殖能を有する肝前駆細胞様の細胞へ脱分化することが判明した。「dediHep」と名付けたこれら脱分化型肝細胞は、単層培養下において上皮細胞と間葉系細胞のハイブリッド状態を呈しており、この状態への脱分化誘導と脱分化状態の維持がHippoシグナル伝達経路の阻害に依存し、TGF-βシグナル伝達経路の活性化には依存しないことが明らかになった。単層培養下でdediHepは、間葉系細胞マーカーであるビメンチンの発現に依存して未熟な状態のまま安定的に増殖するが、三次元浮遊培養下では凝集体を形成して増殖を停止し、成熟肝細胞の機能特性を再獲得することが判明した。また、dediHepから再分化した肝細胞を高チロシン血症1型モデルマウスの肝臓へ移植すると、肝臓組織を長期にわたり再構築することが可能だった。
dediHepは肝臓以外の腸上皮にも分化、オルガノイドは大腸上皮組織を長期間機能的に再構築
dediHepが上皮細胞と間葉系細胞のハイブリッド状態という特殊な表現型を有することから、dediHepが肝臓以外の内胚葉由来臓器の細胞へも分化できるのではないかと考え、その検証を行った。すると、単層培養下にあるdediHepの90%以上が、腸上皮細胞の分化に必須の転写因子であるCdx2を発現していることがわかった。
そこで、胎生期腸前駆細胞の培養条件(三次元マトリゲル培養)でdediHepを培養した。その結果、生体由来の腸前駆細胞と同様に、dediHepが一層の上皮細胞から成る球形のオルガノイドを形成し、そのオルガノイドが長期間安定的に増殖可能なことが判明した。さらに、これらdediHep由来の腸上皮オルガノイドを大腸炎モデルマウスの大腸へ移植すると、大腸上皮組織を長期間、機能的に再構築することが可能だった。
腸への分化にはCdx2過剰発現が重要、上皮細胞と間葉系細胞の混在で予想外の分化能を獲得
このように、dediHepは胎生期腸前駆細胞への分化能を有することが明らかになったが、その一方で、生体由来の胎生期腸前駆細胞とは異なり、成体型の腸幹細胞まで成長することはできなかった。研究グループは以前の研究で、マウスの皮膚の細胞を胎生期腸前駆細胞へ直接的に変化させるダイレクトリプログラミングの方法を開発しているが、その際に作製された胎生期腸前駆細胞は、成体型腸幹細胞まで成長することができた。ダイレクトリプログラミングの誘導にはCdx2の過剰発現が必要だったため、dediHep由来胎生期腸前駆細胞を成体型腸幹細胞まで成長させるためには、Cdx2の過剰発現が必要なのではないかと考えた。
そこで、dediHepに対してCdx2の過剰発現を行った。その結果、dediHep由来胎生期腸前駆細胞は、成体型腸幹細胞が形成する複数の突起を持った特殊な形状のオルガノイドを形成し、腸上皮組織を構成する吸収上皮細胞、杯細胞、パネート細胞、腸内分泌細胞への多分化能を有することが判明した。以上の知見は、肝細胞が単層培養下で上皮細胞と間葉系細胞のハイブリッド状態を呈することにより、予想外の分化能を獲得することを示している。
ビメンチンを含む間葉系細胞マーカーの発現は、マウスおよびヒトの肝細胞において、重篤な肝障害時に生じる肝細胞の前駆細胞化、並びにこれまでに報告された培養下での肝細胞の脱分化誘導でも観察される。したがって、上皮細胞の表現型を失うことなく間葉系細胞の表現型を獲得することは、肝細胞が前駆細胞へ脱分化する際の重要なイベントであり、肝細胞が高い可塑性を発揮するための鍵になっていると考えられた。
dediHep研究が、肝臓など内胚葉由来臓器治療戦略の重要な知見となる可能性
今回の研究では、dediHepが肝細胞と腸上皮細胞に分化できることが示された。このユニークな特徴に加え、dediHepは、適切な条件で培養すれば、肺、胃、膵臓など、他の内胚葉由来臓器の細胞にも分化できる可能性がある。重度の肝障害では、肝臓において腸や膵臓への形質転換が誘導されることがある。これは、肝細胞から肝臓以外の内胚葉由来臓器の細胞への分化転換が特定の条件下で起こり得ることを示唆している。
「dediHepの研究がさらに進めば、細胞の性状維持と可塑性の根底にある分子メカニズムについての理解が進み、肝臓や他の内胚葉由来臓器の疾患に対する治療戦略に対し、重要な知見をもたらすことが期待される」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果




