腸内細菌の働きで代謝された油成分が、免疫応答にどのような影響を与えるのか?
東京理科大学は5月7日、腸内乳酸菌による脂肪酸代謝産物が抗炎症作用を示し、炎症性腸疾患を緩和することを明らかにしたと発表した。この研究は、同大先進工学部生命システム工学科の西山千春教授らと、京都大学 農学研究科の小川順教授、岸野重信准教授、東北大学 東北メディカル・メガバンク機構 機構長の山本雅之教授、東京理科大学 薬学部薬学科の市原学教授との共同研究によるもの。研究成果は、「Frontiers in Immunology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
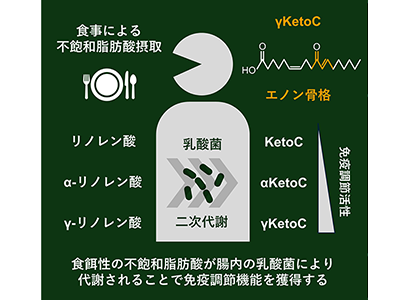
腸内では食品成分由来の物質を基質として、細菌の働きにより、さまざまな二次代謝産物が生成されている。最近の研究では、腸内乳酸菌「L. plantarum」酵素の触媒作用により、食品中の脂肪酸がヒドロキシ脂肪酸、オキソ脂肪酸、エノン脂肪酸、飽和脂肪酸などの誘導体に変換され、これらの代謝中間体が代謝改善作用など、宿主の健康に対して良い効果をもたらすことがわかってきた。しかし、これらの脂肪酸代謝産物が免疫応答に与える影響については未解明のままだった。
研究グループはこれまで、食品成分や腸内細菌代謝産物などが免疫応答調節に与える影響について研究を進めてきた。2024年1月には食物繊維から生成される短鎖脂肪酸がマスト細胞を介して、アレルギー疾患を抑制することを明らかにした。さらに今回、個体・細胞・遺伝子レベルの解析を駆使し、腸内細菌の働きによって代謝された油成分が、免疫応答にどのような影響を与えるのかを解明することを目的として研究に取り組んだ。
エノン脂肪酸、特に樹状細胞からの炎症性サイトカイン分泌を強く抑制
研究では、腸内乳酸菌L. plantarum由来の転換酵素を用いて、多価不飽和脂肪酸からヒドロキシ脂肪酸、オキソ脂肪酸、エノン脂肪酸を調製し、それぞれの脂肪酸が免疫反応に影響を及ぼすのかについて検討を行った。
マウス脾臓より調製した免疫細胞を用いて調べたところ、ヒドロキシ脂肪酸類には免疫活性への影響が見られなかったが、エノン脂肪酸(KetoC, αKetoC, γKetoC)処理では抗原刺激誘導性のサイトカイン分泌が著しく減少することがわかった。また、これらの代謝の出発物質であるリノール酸、α-リノレン酸、γ-リノレン酸ではサイトカイン分泌が抑制されなかったことから、脂肪酸が代謝変換によって新たな機能を獲得したことが示唆された。
さらに、単離した各種免疫細胞を用いて解析を進めた結果、エノン脂肪酸は、LPS(リポポリサッカロイド)などのさまざまな菌体成分によって引き起こされる炎症反応、特に樹状細胞からの炎症性サイトカイン分泌を強く抑制することが判明した。
γKetoCがNRF2経路を刺激し、LPS誘導性IL-6とIL-12p40産生を負に調節
続いて、最も強い活性を示したγKetoCを用い、抗炎症効果が発揮されるメカニズムを調べた。まず、長鎖脂肪酸の受容体として知られるGPCRの関与を検証するためGq型GPCRのアゴニストであるGW9508で樹状細胞を処理したところ、用量依存的に炎症性サイトカインの産生が抑制されることが判明した。樹状細胞にはGW9508反応性のGPCRのうちGPR120が発現していることから、γKetoCはGPR120を介してLPS誘導性の樹状細胞の活性化を抑制することが予想された。
そこで、樹状細胞をγKetoCで処理する際にGqタンパク質αサブユニットの阻害剤を添加したところ、γKetoCの抗炎症効果は一部のサイトカイン(TNF-α)で低減したことから、Gq型GPCRが部分的に関与するものの、他の作用点の存在も示唆される結果となった。
次に、樹状細胞においてγKetoCがNRF2の活性化を介して抗酸化作用を誘導するか否かを確認する実験を行ったところ、γKetoC処理された樹状細胞ではNRF2タンパク質レベルや、NRF2ターゲット遺伝子のmRNAレベルが増加することが確認された。そこで、NRF2がγKetoCの効果に関わる可能性を解析するために、NRF2欠損マウスを利用した解析を行った。その結果、NRF2欠損マウスの樹状細胞ではLPS誘導性の炎症性サイトカイン分泌のうち、IL-6とIL-12p40産生に対するγKetoCの抑制効果が弱まることがわかった。これらの結果は、γKetoCがNRF2経路を刺激することによって、LPS誘導性IL-6とIL-12p40の産生を負に調節することを示唆している。
γKetoCの経口投与で、NRF2経路を介し腸炎が緩和される可能性
デキストラン硫酸ナトリウム(DSS)誘導性大腸炎モデルマウスを用いて、生体の炎症反応に対するγKetoCの保護効果を検証。その結果、野生型マウスにγKetoCを経口投与すると、疾患活動指数(DAI)スコアの上昇が抑制され、線維化による大腸の萎縮も有意に減少することが判明した。
さらに、γKetoCの投与期間を延長すると、体重減少も有意に緩和され、大腸組織の損傷や炎症性細胞の浸潤が減少し、血清中のTNF-α、IL-6、IL-12p40の濃度上昇が抑制される傾向も確認された。一方、NRF2欠損マウスではγKetoCを投与しても病態は改善されなかった。以上の結果から、γKetoCの経口投与によりNRF2経路を介して腸炎が緩和されることが示唆された。
γリノレン酸そのものではなく、代謝産物の「γKetoC」が鍵と判明
これら一連の実験から、腸内乳酸菌のγリノレン酸代謝によって産生されるγKetoCが腸管内で新たな化合物に変換され、それが抗炎症効果を発揮することが示唆された。
γリノレン酸は自己免疫疾患やアレルギーに対して有効性を示すことが報告されているが、今回の結果は、γリノレン酸そのものではなく、その代謝産物であるγKetoCが鍵を握っている可能性をも提示するものだ。
免疫関連性疾患の治療薬・予防法開発に期待
今回の研究により、γKetoCが過剰な免疫反応に対して抗炎症作用を示し、その機構にGPCRやNRF2の刺激が関与していることが実証された。同研究成果は、免疫反応メカニズムの理解における有用な知見であり、有効成分のより効果的な摂取法などの現実的かつ具体的な治療ストラテジーの提案も含め、免疫関連性疾患の治療や予防に貢献することが期待される。
西山教授は「毎日の食事が免疫細胞の働きを左右するほどの影響があることを、個体、細胞、遺伝子レベルで詳しく解析して証明し、免疫関連疾患の予防や緩和に有効な成分の特定、そのような変換能力のある腸内細菌の開発に寄与していきたいと考えている」と、述べている。
▼関連リンク
・東京理科大学 プレスリリース



