ストレス造血時、造血幹細胞がエネルギー需要をどのように賄っているのかは不明だった
東北大学は4月19日、緊急時における造血幹細胞の代謝調節を解明したと発表した。この研究は、同大大学院医学系研究科と国立国際医療研究センター研究所の田久保圭誉教授・プロジェクト長らの研究グループ、京都大学大学院医学系研究科らの共同研究によるもの。研究成果は、「eLife」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
造血幹細胞は、主に骨髄に存在する希少(全骨髄細胞の0.003%~0.01%)な細胞で、生涯にわたって各種の血液細胞を産生する細胞だ。造血幹細胞は、多くの時間は細胞周期を静止期に留めることで幹細胞の性質を守っていると考えられている。一方、感染症や出血、抗がん剤治療など血液細胞の需要が急増する緊急的な状況では、造血幹細胞は速やかに静止期から離脱して細胞分裂を活発に行い、赤血球、血小板、白血球を産生するとともに造血幹細胞自身を複製することで造血の恒常性を維持しようとする。このような緊急時の造血を「ストレス造血」と言う。ストレス造血を行うためには、細胞を構成するタンパク質や脂質、核酸を活発に合成する必要があり、大量のエネルギーが必要となる。静止期の造血幹細胞はこれらの合成が不活発だが、細胞増殖時に造血幹細胞は急速にエネルギー産生を増加するためのスイッチをオンにする必要がある。このスイッチの仕組みの解明は、抗がん剤治療後の血液の回復やより安全な造血幹細胞移植法の開発にもつながることから重要な課題だ。
一般に細胞は、ブドウ糖や脂肪酸などの栄養素を細胞内に取り込み、細胞内での代謝を通じて栄養素の持つ化学ポテンシャルをアデノシン三リン酸(ATP)という分子に変換することで細胞内のエネルギー需要をまかなっている。酸素が乏しい状況では無酸素でブドウ糖を乳酸に変換する解糖系がエネルギー産生に寄与するが、効率は高くない。一方、酸素が十分にある状況では細胞内小器官のミトコンドリアでブドウ糖や脂肪酸に由来する分子を二酸化炭素と水に分解することで、高効率にATP産生を行う。
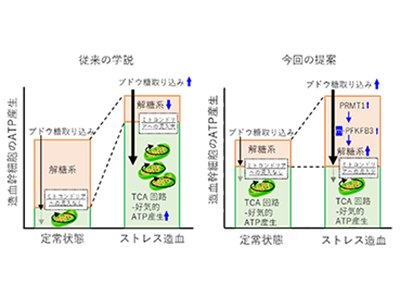
これまで造血幹細胞は骨髄が低酸素環境であることから、静止期の状態では解糖系によるエネルギー産生が中心的な役割を果たすと考えられ、ストレス造血のように大量のエネルギーが必要な状況ではミトコンドリアの活性化による高効率なエネルギー産生が重要と考えられていた。しかし、従来技術ではATPを直接測定するには大量の細胞を溶解する必要があり、ATP産生のようなダイナミックな変化を高い解像度かつ少数細胞で捉えることはできていなかった。
ストレス造血時の造血幹細胞は、F6PをF1,6BPに変換する代謝流束が最も亢進すると判明
研究グループは、ストレス造血時のモデルとして、抗がん剤投与後の造血回復を模倣した5フルオロウラシル(5-FU)投与モデルを用いて、マウスから増殖する造血幹細胞を採取した。まず、細胞内のグルコースがどのような分子に変換されるのかを確認するため、採取した造血幹細胞を非放射性炭素同位体13Cでラベルしたグルコース存在下で培養し、高感度のイオンクロマトグラフ/質量分析技術(ICMS)を用いて、網羅的に13Cで標識された代謝分子を定量測定した。この結果と、OpenMebiusによる数理モデリングを組み合わせることで、ストレス造血時の造血幹細胞は、解糖系の中でもフルクトース6リン酸(F6P)をフルクトース1,6ビスリン酸(F1,6BP)に変換する部分の代謝流束が最も亢進していることが判明した。
また同時に、従来の予想とは異なりミトコンドリアへのグルコース由来の代謝物の流入は解糖系の活性化に比べると限られており、ストレス造血時の増大したエネルギー需要は主に解糖系の活性化によって担われていることが推測された。しかし、まだこの時点では解糖系の活性化とATP産生が結びついているかは決定的ではない。そこで、Förster共鳴エネルギー移動(FRET)を利用した細胞内ATP濃度をリアルタイムで計測できるバイオセンサーGO-ATeam2を全身の細胞で発現するマウスから造血幹細胞を採取し、さまざまな状態で造血幹細胞内のATP濃度を測定した。
造血幹細胞の増殖にはPFKFB3を介した解糖系の活性化によるATP産生が必須
その結果、解糖系阻害時の増殖期の造血幹細胞は、静止期と比べてより早くATP濃度が低下する一方、ミトコンドリア阻害時の増殖期と静止期の造血幹細胞でATP濃度の低下に差がなかった。この増殖期の造血幹細胞の代謝特性を規定する分子を探した結果、解糖系の調節因子の一つ・PFKFB3に辿り着いた。PFKFB3の阻害は解糖系の阻害と全く同じパターンでATP濃度が低下することから、ストレス造血時の造血幹細胞の解糖系によるATP産生はPFKFB3に依存していることを明らかにした。詳細な解析からPFKFB3はPRMT1を介したメチル化という修飾がされることで活性化されることが推測された。最後にCRISPR/Cas9システムを用いて造血幹細胞のPFKFB3を欠損させると、5-FU投与後の血球回復が遅くなることがわかった。
以上の結果から、造血幹細胞の増殖にはPFKFB3を介した解糖系の活性化によるATP産生が必須であることが示された。
より安全な造血幹細胞移植技術の開発や、抗がん剤投与後の血球回復の治療法開発に期待
今回の研究により、ストレス造血時の造血幹細胞は、PFKFB3を介した解糖系の活性化によってATPが産生されていることが明らかとなった。ストレス造血は抗がん剤投与後、造血幹細胞移植時や感染といったさまざまな治療や病態における血球の再生過程に重要な役割を果たすことから、PFKFB3をターゲットとした、より迅速な血液再生治療法の開発に結び付くことが期待される。加えて、同研究で用いた細胞内ATPセンサーを用いる測定系が、少数細胞でのATP代謝を理解するための強力なプラットフォームであることが示された。
「ATP代謝は細胞機能の根幹を担うことから、造血幹細胞のみならず、さまざまな組織の幹細胞のような希少な細胞集団のATP産生調節機構を明らかにしたり、がんの再発や転移に関わるがん幹細胞のような疾患細胞の代謝のアキレス腱をターゲットにした治療法の開発につながったりすることも期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース




