有効な薬物治療がない糖尿病性神経障害、発症や増悪の詳細なメカニズムは未解明
新潟大学は4月15日、糖尿病の合併症である糖尿病性神経障害のモデル動物の性質を調べ、糖尿病性神経障害において細胞外基質のコンドロイチン硫酸(CS)が細胞間での情報伝達を仲介する重要な役割を果たしていることを世界で初めて解明したと発表した。この研究は、同大大学院医歯学総合研究科神経生化学分野の五十嵐道弘教授(研究当時)、血液・内分泌・代謝内科学分野の石黒創特任助教、同研究科薬理学分野、同大医学部メディカルAIセンター、神戸薬科大学、東京都医学総合研究所らの研究グループによるもの。研究成果は、「iScience」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
糖尿病は、日本では潜在的患者数を含めて2千万人いるとも言われる生活習慣病である。その恐ろしさは高血糖が持続することによる血管障害のさまざまな合併症が生じることで、患者のQOLを下げ、大きな社会問題となっていると言える。中でも糖尿病性神経障害は末梢神経障害の中で圧倒的に患者数が多く、糖尿病の比較的初期の段階から発症し、感覚鈍麻(手足の感覚が鈍くなること)や異常感覚(しびれ感などの不快な感覚)などの症状が患者を苦しめている。しかし、現在も血糖値のコントロール以外に、有効な薬物治療などがない。他の合併症では、腎症の人工透析や網膜症のレーザー治療などの治療法が開発されている点からも、新しい治療法の戦略が望まれている。
糖尿病性神経障害の難治性の理由の一つは、その発症機序や増悪のメカニズムについて多くの研究がなされてきたにも関わらず、よくわかっていない点にある。これまで糖尿病性神経障害は、神経細胞が高血糖にさらされたとき、細胞の中でどのような代謝の変化が起こるかを中心に研究が進められてきたが、研究グループは、「細胞間での高血糖に基づく情報伝達の変化」に深く関わる細胞外基質の役割を明らかにすることを目的とした。
CS合成酵素欠損マウス、高血糖状態でもTGF-βシグナル抑制され神経障害が著減
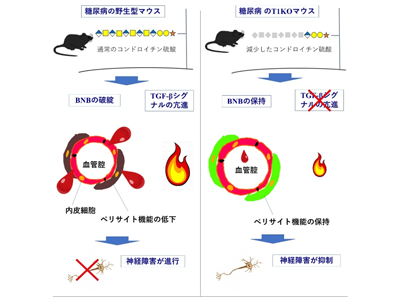
細胞外基質は、細胞同士の間に介在する、細胞間がやり取りする情報伝達を仲介・介助する役割の構造である。その中でもCSという糖鎖に着目した。
CSは軟骨・関節などに多く存在するが、実は全身の細胞外基質の主要成分で、どの臓器にも存在している。2010年に研究グループは、この合成経路の中で最も重要(律速段階)と考えられる糖転移酵素CSGalNAcT1(T1)が働かないマウス(T1KO)を作成し、このマウスでさまざまなヒト病態のモデルを作成すると、著しく症状が軽減することを見出した(例えば、脊髄損傷の回復が起こること、多発性硬化症の症状がかなり軽くなることなど)。このマウスはさまざまな解析から、どの臓器でもCS量が大体3分の1から2分の1程度は減少することが知られている(他にも多数の酵素がCS合成に関係しているため、T1のみを欠損させてもCS量は0にはならず、成育途中で死亡はしない)。
T1KOを高血糖状態にしたところ、血糖値は高いにもかかわらず、通常のマウス(野生型マウス:WT)に比較して神経障害の症状が著しく軽減することを見出した。そこで起こっている変化をさまざまな方法で調べたところ、細胞間で炎症の情報伝達に関わるTGF-βシグナルが抑制されていることが症状軽減につながっていることを発見した。
欠損マウスは血管と神経系の相互作用が安定、高血糖下でも神経が壊れにくい
T1KOとWTそれぞれに高血糖を生じさせると、WTでは手足の感覚の低下が起こるのに対し、T1KOでは感覚の変化が起こらない。感覚を司る神経の様子を調べると、WTでは神経伝導速度(神経で電気信号が伝わるスピード)が低下し、かつ神経の変性が起こり、正常な神経の残存数がかなり少なくなっていた。一方、T1KOでは神経伝導速度は正常で、かつ神経の数はWTと全く変わらない。神経再生現象を表すGAP-43というタンパク質のリン酸化抗体で確認しても変化が見られないので、T1KOの神経は、高血糖にさらされても壊れにくい状態にあることがわかった。
さらにT1KOでは出生直後の網膜の血管系を用いた実験系で、ペリサイトが血小板由来成長因子PDGFの受容体(PDGFRβ)に対する抗体に、WTと比較して著しく抵抗性であり、血管と神経系の相互作用がより安定と考えられる結果を得た。ヒトの糖尿病合併症は血管の障害が主たる誘因と思われるため、この結果から細胞間の相互作用が想起される。CS量が減少することで、T1KOでは高血糖時に細胞死を誘発する遺伝子の発現が有意に低く、WTでは高血糖で働く遺伝子が、T1KOでは働きにくくなることが想定された。
RNA-seq解析で、高血糖で作動する炎症因子TGF-βの働きが減弱していると判明
しかし、これまで糖尿病性神経障害の病態モデルで報告されていた遺伝子の変化がほとんどなく、どのような仕組みでこの変化がWTで起き、T1KOでは抑えられるのかは不明だった。そこで研究グループは、RNA-seqによって発現する遺伝子群の変化を網羅的に比較してその特徴を感覚鈍麻の現れ方と比較した。
その結果、TGF-βという炎症の時に働く因子の受容体の発現がWTの高血糖群では上昇しており、T1KOでは全く変化していないことが見出された。この因子が働いていると、Smad2/3というタンパク質のリン酸化が細胞内で生ずるため、このリン酸化状態の変動を調べると、WTでは高血糖になると正常時に比べて急速にリン酸化が増大して変化の比率が大きくなるが、T1KOでは変化の比率が小さいことがわかり、TGF-βの働きが弱まっていることが明確になった。よって、通常は高血糖で作動する炎症シグナルTGF-βが神経細胞にダメージを与えて糖尿病性神経障害の発症・増悪に寄与するところが、細胞外基質のCS合成量が低下していると、細胞間でのTGF-βの働きが減弱して神経へのダメージが生じにくくなることが明らかになった。
今後、糖尿病性神経障害の患者でも同様の変化が見られるか調べる予定
血管系と神経系の相互作用を含めて、このマウスモデルにおいては、糖尿病性神経障害を引き起こし、それを増悪させるTGF-βのシグナル伝達が、CSやそれが存在している細胞外基質部分で調節されていることが明らかとなり、CSの量が減っているT1KOではこの反応が非常に起こりにくくなっていることが示された。これは糖尿病性神経障害に関して、これまでは全く不明であった細胞間のコミュニケーションを介する病気の成り立ちを、初めて示唆するものと考えられる。
一方、糖尿病性神経障害の患者ではまだこの点が明らかになっていない。今後は糖尿病性神経障害の患者に同様の成り立ちが考えられるかどうかの証拠を集める必要があると思われる。仮にマウスモデルと共通性のある変化が見出された場合には、それをもとに診断・治療の開発ができる可能性がある。「ごく初期の変化を捉える鋭敏な診断法や、新たな治療戦略に基づいた創薬、化合物の発見、といった可能性が考えられ、長い道のりではあるが、糖尿病性神経障害を克服できる第一歩がこの研究から生まれることが期待される」と、研究グループは述べている。
▼関連リンク
・新潟大学 ニュース




