膵がんやその前がん病変IPMN、C末端アミノ酸変化のapoA2-ATQ/AT量が低下
日本医科大学は4月12日、開発を進めてきた膵がん患者の血液中でのAPOA2アイソフォームを測定する試薬の体外診断用医薬品が、膵がんの診断補助として公的医療保険での検査が可能になったと発表した。この研究は、同大大学院医学研究科本田一文大学院教授、国立がん研究センター、東レ株式会社らの研究グループによるもの。研究成果は、「Journal of Gastroenterology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
膵がんは早期に発見できれば生存率の向上が期待されるが、自覚症状が現れにくく進行が早いため、早期に発見することが難しいがんの一つである。研究グループは、膵がん前がん病変であるIPMN、リスク疾患である慢性膵炎・膵嚢胞、膵がん間接所見である主膵管拡張、膵脂肪浸潤などを診断する血液バイオマーカーの開発、そして膵がんリスク疾患を診断する血液バイオマーカーの体外診断用医薬品の開発と実用化を目標に研究を進めてきた。
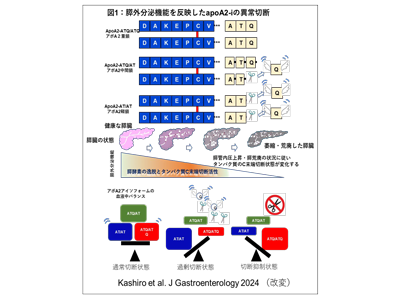
これまでに研究グループは、膵がんや膵がんリスク疾患、健常者の血液中を循環するタンパク質の質量分析プロファイルからapolipoprotein A2 2量体タンパク質のC末端アミノ酸が欠失したアイソフォーム(apolipoprotein A2-isoforms:apoA2-i)の量比が変化することを発見、特に、apoA2-iのうちC末端アミノ酸配列がATQ/AT型となるapoA2-ATQ/AT(アポA2中間鎖)が、膵がんや膵がん前がん病変であるIPMN患者では、健常者の血漿濃度に比べて有意に低下することを発見していた。
そこで、ApoA2-ATQ/ATQ型(アポA2重鎖)とapoA2-AT/AT(アポA2軽鎖)に反応する抗体を作製し、apoA2-ATQ/AT濃度(apoA2-IIndex)を推定するELISA検査系(APOA2アイソフォーム)を確立した。同APOA2アイソフォーム検査キットを用いて、体外診断用医薬品承認申請に必要な臨床性能試験を実施した。
APOA2アイソフォームELISAキット、国内試験で既存腫瘍マーカーと同等以上の臨床性能
日本国内臨床性能試験の結果、ROC解析による膵がん患者を健常者集団から判別するROC曲線下面積値(AUC)の点推定値は、APOA2アイソフォームが0.879と臨床で膵がん診断に利用されるCA19-9のAUC点推定値の0.849より高く、膵がんの既存腫瘍マーカーである「CA19-9」と同等以上の臨床性能が確認できた。2,000人の健常者血漿検体を用いて、その95%が陰性となる測定値を閾値(カットオフ値)としたときのAPOA2アイソフォームの血漿濃度は59.5μg/mLとなり、カットオフ値の決定には利用しなかった400人で、カットオフ値の再現性を確認しても、健常者の95.8%の集団が正確に判定された。
~2㎝膵がん発見感度、CA19-9単独33.3%だがAPOA2アイソフォーム追加で66.7%
膵がんを発見するAPOA2アイソフォーム(カットオフ値59.5μg/mL)とCA19-9(カットオフ値37U/mL)の感度・特異度のうち、特にI期(n=19)におけるAPOA2アイソフォームとCA19-9の感度は、それぞれ47.4%、36.8%となった。2㎝以下膵がん(TS1)(n=15)を発見する感度は、CA19-9単独では33.3%だったが、APOA2アイソフォームを加えるとその感度が66.7%に上昇した。APOA2-iTQとCA19-9単独測定の特異度はいずれも95.3%だった。ApoA2-i Indexは膵がんのいずれのステージでも健常者に比較して血漿濃度が減少した。
米国施設でのブラインド測定でも国内試験と同様の性能を確認
米国国立がん研究所早期診断研究ネットワーク(National CancerInstitute Early DetectionResearch Network:NCI EDRN)では、開発されたバイオマーカーの臨床性能を確認するための盲検試験を行い、そのバイオマーカーの性能評価を行う。NCIからI/II期などの切除手術可能期(ステージI/II)の膵がん血漿検体を入手し、米国の測定施設でAPOA2アイソフォームのブラインド測定を実施した。I/II期膵がん(n=98)を健常者から判別するAUCは、APOA2アイソフォームが0.836、CA19-9では0.783となり、その点推定値は日本で実施された臨床性能試験結果と同様に、APOA2アイソフォームがCA19-9に比較して高く、再現性が確認された。また、米国人健常者リファレンスサンプルの95%点をAPOA2アイソフォームのカットオフ値と定義し(54.47μg/mL)、膵がん患者の感度と特異度を確認した。
原理が異なる既存のCA19-9との組み合わせで、診断に貢献できると期待
最近、腫瘍細胞から微量に漏出するタンパク質、核酸、細胞小胞、代謝物、糖鎖などを総合的に分析して多種類のがん早期診断を可能にするリキッドバイオプシー(multi cancer early detection:MCED)が注目を集めている。一方で膵がんの診断を補助するバイオマーカーとして、臨床的に利用されている体外診断用医薬品は1970年代に臨床開発されたCA19-9をはじめとしたがん細胞が産出する糖鎖バイオマーカーだけである。今回の研究成果により、40年ぶりにCA19-9と同等以上の性能を持つ腫瘍マーカーが体外診断用医薬品として認可され、実際の臨床現場で健康保険により利用できるようになった。既存の膵がん腫瘍マーカーであるCA19-9とは全く原理が異なるため、組み合わせることで、膵がんの診断に貢献できると考えられる。「日本国内からこのようなバイオマーカーが探索から臨床開発され、世界に先駆けて体外診断用医薬品として社会実装されたことは大変喜ばしい」と、研究グループは述べている。
▼関連リンク
・日本医科大学 プレスリリース



