MUC6遺伝子変異のある胃がんは治療抵抗性を示すが、胃がん発生への関与は不明
東京大学は4月11日、ムチン(粘液)の一種であるMUC6の喪失が直接胃がんの発生を引き起こすことを明らかにしたと発表した。この研究は、同大医学部附属病院消化器内科の新井絢也医師、早河翼講師、藤城光弘教授と、産業技術総合研究所細胞分子工学研究部門多細胞システム制御研究グループの舘野浩章研究グループ長らの研究グループによるもの。研究成果は、「Gastroenterology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ピロリ菌除菌療法の普及・感染率の低下により胃がん患者数のゆるやかな減少が見られているが、依然として胃がんによる死亡者数はがん死亡者数全体の上位を占めている。手術のできない進行胃がんは既存の薬物療法に対し抵抗性を示すことが多いため、新規発がん経路の同定、新規治療標的の探索が待たれている。
近年、胃がんの全ゲノム解析の結果が報告され、MUC6遺伝子変異が胃がんの10%程度で見られた。MUC6遺伝子変異を有する胃がんは治療抵抗性を示しやすく、予後不良であることがこれまで報告されてきたが、胃がん発生への関与は不明とされてきた。
発がん経路としてMAPK経路活性化を同定、MEK阻害薬でマウスの腫瘍が著明に縮小
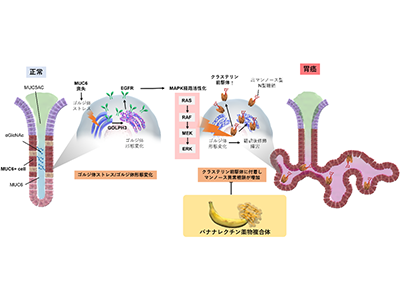
研究グループは今回、独自にMUC6遺伝子を欠損・無効化させたMUC6KOマウスを作成し、MUC6喪失により直接胃がん発生が引き起こされることを世界で初めて発見し、その発がん経路、新規治療標的の提案を行った。
MUC6KOマウスは3か月齢程度で異形成を示し、半年齢以降全個体で胃がんが観察され、12か月齢では粘膜下に浸潤する浸潤がんを呈した。その発がん経路として、RNAシークエンスなどの解析によりMAPK経路活性化が同定され、MEK阻害薬で腫瘍が著明に縮小することが判明した。
MUC6喪失<ゴルジ体ストレス<GOLPH3発言<ゴルジ体形態変化<MAPK経路活性化
電子顕微鏡で細胞小器官を観察すると、ゴルジ体の形態変化(膜同士の距離が広がり全体として膨張)が見られ、それに付随してゴルジ体ストレスマーカーであるGOLPH3遺伝子が高発現していることが判明した。
そこで、GOLPH3のノックアウトマウスを用いてGOLPH3遺伝子の発現を低下させると、MAPK経路活性の低下、腫瘍縮小が観察されたことから、MUC6KOマウスにおける発がん経路は、ゴルジ体ストレスを介したGOLPH3遺伝子-MAPK経路の活性化であることが示された。
バナナ由来レクチンを含む薬物複合体に腫瘍縮小効果
さらに、ゴルジ体ストレスに付随してMUC6KOマウスにおける腫瘍部分ではマンノースという異常糖鎖が高発現していることが、レクチン解析、糖鎖の質量分析により判明した。GOLPH3-MAPK経路の異常およびマンノースの高発現は、MUC6遺伝子変異を伴うヒト胃がん患者の細胞・検体でも確認された。
このがん細胞だけに発現する異常マンノース糖鎖に着目した本研究グループは、マンノースに特異的に接着する新規レクチン薬物複合体を開発した。バナナ由来のレクチンに遺伝子改変を施し、リンカ―を介して緑膿菌外毒素を接着させた、バナナレクチン薬物複合体だ。その結果、MUC6KOマウス、またMUC6喪失を伴うヒト胃がん細胞株を用いたゼノグラフトにおいて、このバナナレクチン薬物複合体は腫瘍縮小効果を認めた。
バナナ由来化合物の、実臨床への応用に期待
今回の研究により、MUC6喪失に伴う新しい胃がんの発生メカニズムとしてゴルジ体ストレスを介したGOLPH3遺伝子-MAPK経路の活性化が見出された。さらに治療標的として、異常糖鎖に着目したバナナ由来レクチン薬物複合体が提案された。これまでもムチン遺伝子変異、糖鎖転移酵素遺伝子変異による、種々の臓器における多種多様な疾患に対する関与が示されてきたが、そのメカニズムは不明だった。
「本研究成果により、より幅広い疾患におけるゴルジ体ストレス、GOLPH3遺伝子の関与の検証がされ、その治療標的として、異常糖鎖に着目したレクチン薬物複合体の活用が期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




