筋萎縮性側索硬化症などで見られる異常タンパク質の細胞間伝播、抑制する治療は未開発
大阪大学は3月28日、筋萎縮性側索硬化症(ALS)に、軸索ガイダンス因子であるRepulsive guidance molecule-a(RGMa)が関与していることを解明したと発表した。この研究は、同大大学院医学系研究科の奥野龍禎准教授、清水幹人招へい教員、白石直之招へい教員、多田智招へい教員、望月秀樹教授(神経内科学)、山下俊英教授(分子神経科学)らの研究グループによるもの。研究成果は、「Science Advances」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ALSは徐々に筋力低下・筋萎縮が進行し、数年の経過で最終的には嚥下機能・呼吸機能の低下を来し死亡する、重篤な運動ニューロンの変性疾患である。その原因はまだ十分に明らかになっていないが、異常タンパク質が脊髄前角細胞に蓄積することが一つの原因であると考えられている。またこのタンパク質の異常蓄積が細胞間を伝播し広がることで、病状が悪化することが知られており、プロパゲーションと呼称される。このプロパゲーションはALS以外にもアルツハイマー病やパーキンソン病などのタンパク質が中枢神経に異常蓄積する疾患全般に想定されている病態であり、この制御ができれば神経変性疾患の進行を抑えられると考えられてきた。しかし現時点ではこのプロパゲーションを抑制する治療はまだ十分に考案されていない。
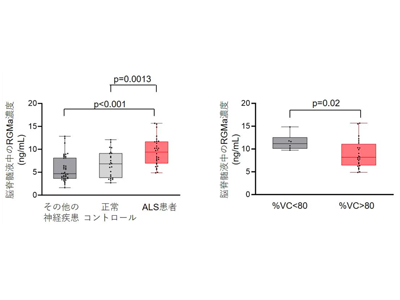
脳脊髄液中のRGMaはALSの呼吸状態と相関、抗RGMa抗体はALSマウス寿命の延長と臨床症状を軽減
研究グループは、まずALS患者の脳脊髄液中におけるRGMaが増加することを見出した。脳脊髄液中のRGMa濃度はALSの呼吸状態と相関がみられ、病勢を予測するバイオマーカーとして使用できることも確認した。また、抗RGMa抗体(田辺三菱製薬株式会社提供)をALS動物モデルであるG93A変異SOD1トランスジェニックマウス(mSOD1マウス)に使用したところ、寿命の延長と臨床症状の軽減が得られ、変異SOD1タンパク質の凝集が低下することを発見した。
神経細胞の細胞骨格動態をRGMaが変化、バリア機能低下しプロパゲーション促進
さらにこの動物モデルと培養細胞を用いた解析により、RGMaはアクチンを中心とした細胞骨格動態を変化させて神経細胞の異常タンパク質に対するバリア機能を低下させ、異常タンパク質のプロパゲーションを促進することでALS病態を悪化させていることが明らかとなった。
RGMa増加による病態機序、バイオマーカーや治療標的としても有望
今回、致死的疾患であるALSの中枢神経においてRGMaが増加して細胞骨格動態を変化させることによりバリア機能を低下させ、異常タンパク質のプロパゲーションを促進するという新しい病態機序を示すとともに、バイオマーカーや治療ターゲットとして有望であることを明らかにした。「この結果により、ALSだけでなくアルツハイマー病やパーキンソン病などプロパゲーションを介して病態が悪化するさまざまな疾患に対して、全く新しい治療戦略の可能性を提供できたものと考える」と、研究グループは述べている。
▼関連リンク
・大阪大学 ResOU




