炎症収束型のマクロファージ、どのようにアレルギーを抑制するのか未解明だった
東京医科歯科大学は3月12日、皮膚アレルギー炎症局所の1細胞RNAシーケンス解析を行い、皮膚にやってきた炎症性単球がアレルギーを抑制するマクロファージへと変化していく仕組みを解明したと発表した。この研究は、同大高等研究院炎症・感染・免疫研究室の三宅健介特任助教、伊藤潤哉大学院生、髙橋和総大学院生、烏山一特別栄誉教授、教養部の中林潤教授、順天堂大学、東京理科大学、ケープタウン大学らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
日本においてアトピー性皮膚炎をはじめとするアレルギー疾患の罹患者数は非常に多く、患者のQOL低下や医療費負担の増加が社会的に問題となっている。しかしながら、アレルギーの病態にはいまだ数多くの不明点が残されており、その病態の解明が求められている。
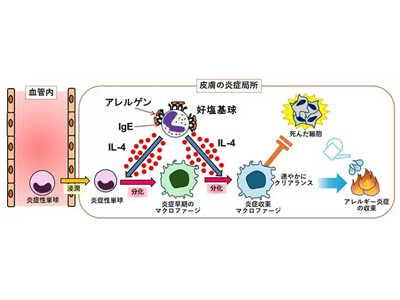
研究グループは以前、慢性皮膚アレルギー炎症のモデルマウスを開発し、抗体の一種であるIgEと希少な免疫細胞である好塩基球がこのアレルギーモデルの誘導に重要であることを明らかにしてきた。さらに、このアレルギーモデルマウスにおいて、末梢血を循環する炎症性単球が皮膚へとやってきて炎症収束型のマクロファージへと変化することで、アレルギー炎症を抑制することを解明した。しかしながら、この炎症収束型のマクロファージが、どのような経路で誘導され、さらにどのようにアレルギーを抑制しているのか、その仕組みはよくわかっていなかった。
炎症性単球・好塩基球が皮膚へ侵入<IL-4産生<中間型から炎症抑制型マクロファージへ
アレルギーモデルマウスにおいて炎症を抑えるマクロファージの性質を調べるため、研究グループは、アレルギーが起こっている現場に存在する1つ1つの細胞の遺伝子発現を網羅的に調査できる1細胞RNAシーケンス解析を用いて、アレルギーが起こった皮膚の細胞を解析した。その結果、血中を循環する炎症性単球が皮膚に入ってきたのち、まず中間型のマクロファージへと変化し、最終的に炎症抑制型のマクロファージへと変化していくことがわかった。
さらなる解析から、好塩基球の産生するインターロイキン-4(IL-4)が炎症性単球に作用することで、炎症性単球から炎症抑制型のマクロファージへの変化を、引き起こしていることが明らかになった。さらに詳細に炎症抑制型のマクロファージの性質を調査したところ、このマクロファージは死細胞や炎症分子を食べこむ能力が非常に高いことがわかった。反対に、炎症性単球が皮膚に入り込めないマウスであるCCR2欠損マウスでは、炎症現場において炎症抑制型マクロファージの数が極端に減少し、除去されないまま残った死んだ細胞が炎症性分子(インターロイキン-1α)を分泌することで、アレルギー炎症が悪化し、アレルギー症状が長引いてしまうことを発見した。
さらなる解析によりアトピー性皮膚炎などの有望な治療法開発につながる可能性
今回の研究では炎症性単球が皮膚に入った後に段階的に炎症収束型マクロファージに変化していく過程を、1細胞RNAシーケンス解析を用いて精密に解析することで解き明かし、「炎症を悪化させる細胞(炎症性単球)」が「アレルギーを抑制する細胞(炎症抑制マクロファージ)」に変化していく過程を追跡することに成功した。さらに、炎症収束型マクロファージが速やかに死んだ細胞の除去を行うことで、アレルギーが悪化しないように抑えていることを発見した。
「アレルギーを抑制するマクロファージが炎症性単球から誘導される仕組みをより詳しく解析することで、アトピー性皮膚炎をはじめとするアレルギー炎症を効率的に抑制できる有望な治療標的の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




