糖尿病関連腎臓病でミトコンドリアでの電子伝達系はどのように変化しているのか?
岡山大学は3月7日、透析導入の世界最大の原因である糖尿病関連腎臓病(DKD:diabetic kidney disease)の新たな悪化メカニズムと治療ターゲットを発見したと発表した。この研究は、同大学術研究院医歯薬学域(医)腎・免疫・内分泌代謝内科学分野の三瀬広記客員研究員、和田淳教授、泌尿器病態学分野の荒木元朗教授、米国MDアンダーソンがんセンター(MD Anderson Cancer Center)腎臓内科(Nephrology Section)のFarhad R. Danesh教授らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
日本を含めた欧米アジア諸国において、透析の原因となる腎臓病の第一位はDKDである。DKDとは糖尿病やそれに関連した病態の結果起こる腎臓病のことだが、日本においては、近年登場した糖尿病治療薬などの効果で、DKDが原因で透析が開始になる人の数は以前より抑えられている。しかし、「わが国の慢性透析療法の現況2022(日本透析医学会)」によれば、2022年にDKDが原因で透析を継続している人は約13万人(全体の40%)と依然多く、2015~2016年と比べると約1万人増えている。このような背景から、DKDの進行を抑える、治すような新規治療ターゲットの探索、新規治療薬の開発が望まれている。
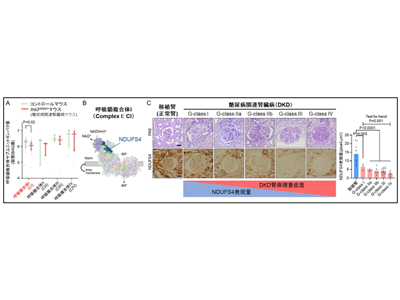
ミトコンドリアはATP(アデノシン三リン酸)というエネルギーやROS(活性酸素種)という酸化ストレスの原因物質を産生する重要な細胞内構造体である。このATPやROSの産生を適切に調整しているのがミトコンドリア呼吸鎖複合体I~IVで構成される電子伝達系であり、呼吸鎖複合体IからIVまで順に電子が流れて行き最終的に呼吸鎖VでATPが産生される反応は酸化的リン酸化と呼ばれる。また、この過程でROSも発生するがROSの発生には呼吸鎖複合体Iが最も寄与すると言われている。この電子伝達系は生体において非常に重要な役割をしているが、DKDで電子伝達系がどのように変化しているかは十分解明されていなかった。
DKDマウスや患者DKD組織で、呼吸鎖複合体IサブユニットのNDUFS4発現低下
そこで、研究グループはまず、DKDのモデルマウス(Ins2Akita/+マウス)において、ポドサイトという腎臓の機能維持に重要な役割を果たしている細胞からミトコンドリアを単離し、プロテオーム解析を行った。その結果、呼吸鎖複合体Iのサブユニットタンパク質量がDKDマウスで低下していることがわかった。その中で、NDUFS4(NADH:ubiquinone oxidoreductase iron-sulfur protein4)というサブユニットは、別の DKD モデルマウス(Leprdb/dbマウス)や、ヒトDKD組織中でも低下していることがわかった。さらに、ヒトDKDの腎病理重症度に比例してNDUFS4の発現量が低下していることがわかった。
ポドサイトNDUFS4過剰発現マウス、DKD進展抑制とミトコンドリア機能改善を示唆
これらの結果から、NDUFS4がDKD進展に大きく寄与していると考え、NDUFS4をポドサイトのみで過剰発現させたマウスを作製し、DKD進展やミトコンドリアの機能評価を行った。その結果、DKDマウスに比してNdufs4過剰発現のDKDマウスでは、DKD進展マーカーであるアルブミン尿が低下しており、ミトコンドリアATPは上昇、ミトコンドリアROSは低下していた。これらの結果より、NDUFS4過剰発現によってDKD進展が抑制され、ミトコンドリア機能が改善することが示唆された。さらに、Ndufs4を過剰発現させた不死化ポドサイトを作製し、高血糖下におけるNdufs4過剰発現の影響を調べたところ、高血糖下で低下したミトコンドリアクリステ密度や呼吸超複合体は、Ndufs4過剰発現によって改善することが確認できた。
NDUFS4はSTOML2と結合しミトコンドリア構造・機能維持、DKDではその相互作用が低下
次に、APEX2を用いた近接依存性標識法、ストレプトアビジンを用いた免疫沈降後プルダウンアッセイ、Complexsomeプロファイリングによって、NDUFS4が呼吸超複合体上で、ミトコンドリアクリステ構成タンパク質であるSTOML2(Stomatin-Like Protein2)と結合し、クリステやミトコンドリアの構造・機能維持に寄与していることがわかった。さらに、高血糖下で低下したNDUFS4とSTOML2の相互作用が、Ndufs4過剰発現によって改善することが、STED MicroscopyやN-STORMといった超解像空間イメージングによっても明らかになった。
以上の研究成果をまとめると、呼吸鎖複合体IのサブユニットであるNDUFS4はクリステ構成タンパク質の一つであるSTOML2との相互作用を介してクリステの構造維持に貢献しているが、DKDポドサイトではNDUFS4の低下に伴い、STOML2との相互作用も低下するため、呼吸超複合体やクリステの密度が低下し、ミトコンドリアの機能・構造異常が生じる。これにより、ポドサイト障害が促進し、DKDが悪化するが、NDUFS4が過剰発現されると、NDUFS4-STOML2相互作用の改善により呼吸超複合体、クリステ密度、そしてミトコンドリア機能が改善する。このことがポドサイト障害に保護的に働き、DKD進展が抑制される。
新規治療ターゲットとして有望、医療費削減にもつながることを期待
今回の研究成果によって、呼吸鎖複合体IとそのサブユニットNDUFS4はDKDの新規治療ターゲットとなることがわかった。ミトコンドリアはエネルギー産生、酸化ストレスの調整を行っている非常に重要な構造体で、NDUFS4はそのミトコンドリア機能を調整する重要な物質であることがわかったため、DKDの状態で低下したNDUFS4を改善させるという治療戦略は非常に理にかなっている。「将来的に、この新しい治療ターゲットを創薬化につなげ、DKDが原因で腎不全になる人、透析になる人を大幅に減らせるように研究を発展させていきたいと考えている。DKDによる透析導入が低下すれば、患者の生活の質が改善するだけでなく、大幅な医療費削減にもつながる」と、研究グループは述べている。
▼関連リンク
・岡山大学 プレスリリース



