パクリタキセルに対する感受性に違いがある細胞株の代謝特性を比較
慶應義塾大学は2月22日、乳がん細胞が化学療法に対する抵抗性を獲得する新たなメカニズムを発見したと発表した。この研究は、同大医学部医化学教室の山本雄広専任講師、医学部外科学(一般・消化器)教室の林田哲専任講師、実験動物中央研究所の末松誠所長(同大名誉教授)らの研究グループによるもの。研究成果は、「Cancer Research」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん細胞はその旺盛な増殖能を賄うため、生存に有利な代謝物を産生することが知られている。また、もうひとつの特徴として、ストレスに対する耐性を持つことが挙げられる。抗がん剤を使い続けていると、がん細胞はさまざまな手段で抗がん剤に対する耐性を獲得してしまい、このことががん治療の大きな障壁となっている。例えば、乳がんには高い再発率と薬剤耐性獲得のために治療成績が芳しくないトリプルネガティブタイプがあり、しばしば抗がん剤の一種であるパクリタキセルへの耐性を獲得してしまう。抗がん剤に対する抵抗性を獲得する機構はさまざまあるが、がん細胞内ではエネルギー産生や細胞の「材料」作りに関わる連鎖的な化学反応が起こっており、がん細胞はその経路をうまく制御して自身の増殖に有利に振る舞うことがわかってきた。しかし、その仕組みの多くは不明のままだ。そこで研究グループは、トリプルネガティブタイプにおいて抗がん剤パクリタキセルに対する感受性に違いがある細胞株に着目し、それぞれの代謝特性を比較するところから研究を始めた。
パクリタキセル耐性細胞のブドウ糖はセリン生合成経路を経て代謝される
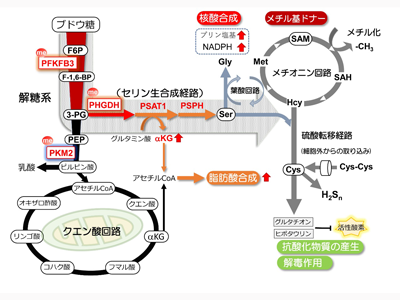
がん細胞は正常細胞よりも大量のブドウ糖を取り込み、解糖系という経路を通じ乳酸へ変換することで、エネルギー源であるATPを産生することが知られている。その急速な細胞増殖を支えるために、核酸(DNA、RNAの材料)やアミノ酸、細胞膜の原料となる脂質など、細胞を構成する上での「材料」が大量に必要になる。これら「材料」の合成経路の多くは解糖系から分岐する。研究グループは取り込まれたブドウ糖がどのように利用されるかを明らかにするべく、安定同位体で標識したブドウ糖をパクリタキセルに対する感受性の異なる2種類の乳がん細胞に取り込ませ、どのように代謝されていくのかを質量分析技術を用いて測定した。その結果、耐性を持つ細胞では、取り込まれたブドウ糖は解糖系から分岐するセリン生合成経路を経由し、核酸合成経路および脂肪酸合成経路にて代謝されることがわかった。
パクリタキセル耐性株でメチル化レベルが高い3つの代謝酵素を特定
セリン生合成経路への経路切り替えのメカニズム解明を試みるため、複数のトリプルネガティブ乳がん由来の乳がん細胞株を比較して、代謝酵素の発現およびその翻訳後修飾の状態を調べた。その結果、パクリタキセルに耐性を持つ乳がん細胞では解糖系の一連の反応で重要な働きを持つ酵素PFKFB3(ホスホフルクトキナーゼ/フルクトースビスホスファターゼ3)およびPKM2(ピルビン酸キナーゼM2)、さらにセリン生合成経路中の重要な制御酵素であるPHGDH(3-ホスホグリセリン酸デヒドロゲナーゼ)が高度にメチル化修飾を受けていることがわかった。
3つの酵素のメチル化修飾の有無が、代謝経路切り替えの「スイッチ」として作用
PFKFB3とPHGDHはメチル化により酵素活性が活性化し、PKM2は逆に活性が低下する。これら3酵素のメチル化はアルギニンメチル化酵素PRMT1(タンパク質アルギニンメチルトランスフェラーゼ1)の働きで制御されており、PRMT1を遺伝子破壊した耐性細胞ではパクリタキセルに対する抵抗性が解除された。これらのことから、3つの代謝酵素のメチル化修飾の有無がパクリタキセルに対する耐性獲得をもたらすための代謝経路切り替えの「スイッチ」として作用することがわかった。
術前化学療法を受けた患者細胞で比較、non-pCR群でメチル化型酵素の核局在の割合が高い
実際のトリプルネガティブ乳がん患者の術前組織診断で使用されたサンプルを用いて、組織切片上の代謝物の分布をイメージングメタボロミクスにて検出を試みるとともに、上記の代謝酵素のメチル化の度合いを免疫染色法にて判定した。その結果、がん細胞集塊部において脂肪酸の合成および分解に関与する代謝物の集積が認められたと同時に、上記の3つの酵素(PFKFB3、PKM2、およびPHGDH)のメチル化型ががん細胞の核内に染色された。また、術前化学療法による病理学的完全奏効(pathological complete response:pCR)が得られた患者の検体5例と得られなかった患者(non-pCR)検体4例で染色比較したところ、non-pCRの患者では有意にメチル化型酵素の核局在の割合が高くなっていることがわかった。
3つの代謝酵素を制御するPRMT1欠損でパクリタキセルの抗腫瘍効果が回復、動物実験で
さらに、マウスへのパクリタキセル耐性乳がんの腫瘍移植実験においても、PRMT1欠損細胞(3つの酵素のメチル化が起こらない)では対照群(耐性株)に比べてパクリタキセルによる腫瘍退縮効果が回復することがわかった。
これらのことから、3つの代謝酵素のメチル化はパクリタキセルに対する薬剤抵抗性の有無の指標となるとともに、メチル化修飾を人為的に抑制することでパクリタキセルの腫瘍縮小効果の回復が見込める可能性があることがわかった。
脂肪酸代謝やメチル化酵素の阻害剤とパクリタキセル併用により薬剤抵抗性を解除できる可能性
今回の研究で明らかになった、タンパク質のメチル化修飾を介した代謝経路切り替えにより、トリプルネガティブ乳がん細胞ではセリン生合成経路が活性化されることに起因する脂肪酸合成能の維持が耐性獲得のメカニズムの一端であることがわかった。今後、代謝酵素のメチル化状態を術前検査で事前に調べることができれば、がんの悪性度や化学治療の奏効を予測する質的診断ができる可能性がある。さらに、脂肪酸代謝の阻害剤やメチル化酵素の阻害剤とパクリタキセルとの薬剤併用によって、単剤では薄かった効果を増強し、薬剤抵抗性を解除できる可能性が示唆された。「研究成果をより発展させることでこれまでのがん治療の限界を克服できる、代謝特性の違いに着目した新しいがん治療法の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース



