ゲノムのジャンク領域とされる反復配列、膵がんで高発現するHSATIIは病態と関連?
東京大学医学部附属病院は2月14日、ゲノムの高度反復配列から転写されるHuman Satellite II(HSATII)と呼ばれるRNAが二重鎖を形成することによって、膵がん細胞の悪性化を促進する可能性があることを明らかにしたと発表した。この研究は、同病院消化器内科の岩田琢磨届出研究員、岸川孝弘助教、藤城光弘教授らの研究グループによるもの。研究成果は、「Journal of Biological Chemistry 」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
分子標的治療や免疫チェックポイント阻害薬の登場によって、抗がん治療は急激な発展を迎えているにも関わらず、膵がんの治療予後は改善に乏しく、現在も難治がんの代表と考えられている。近年、次世代シークエンス技術を用いた遺伝子解析が急速に普及し、がん組織の遺伝子発現情報が簡便に手に入るようになってきた。一方で、ヒトゲノムには反復配列と呼ばれる繰り返し配列からなる領域が存在し、その多くはゲノムの暗黒大陸といわれる非コード領域に存在している。これらはゲノムの約半分を占めているものの、生物学的に機能を持たないジャンク配列と考えられている。
しかし、染色体の中心付近に高度に縦列反復して存在するHSATIIと呼ばれる配列が膵がんで異常発現していることが報告されて以降、研究グループは今まであまり注目されることの少なかったこの領域に着目して、膵がんにおける分子機序の解明と早期がん診断薬の開発の両面から研究を進めてきた。
HSATII RNAの二重鎖形成、膵がん細胞の浸潤と関連することを示唆
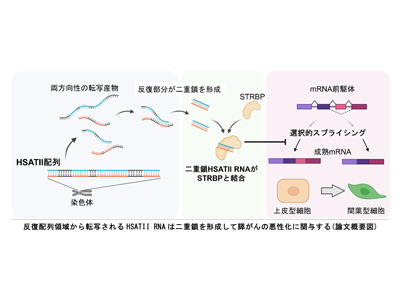
研究を進める中で、HSATII配列は数塩基~10塩基程度のユニット配列が複雑に縦列反復する構造を取るため、両方向性に転写された場合は相補鎖どうしが結合して二重鎖を形成しやすくなるのではないか、という仮説が生まれた。そこで、実際に膵がん細胞を用いて二重鎖HSATII RNAの形成の有無、その分子機能についての検討を行った。
その結果、膵がん細胞株によって形成された腫瘍では他の反復配列と比較してHSATII RNAの発現が著明に亢進すること、それに伴って二重鎖HSATII RNAが形成されるということがわかった。そこで次に、二重鎖HSATII RNAを過剰に発現させた膵がん細胞株ではどのような変化が起きるかを調べた。その結果、二重鎖HSATII RNA発現細胞では上皮間葉転換という形態変化が誘導されており、細胞の浸潤傾向が強まっていることがわかった。
STRBPへの二重鎖HSATII RNA結合、間葉型スプライシングパターンへ移行
この分子機序を調べるために、二重鎖を形成したHSATII RNA特異的に結合するタンパク質を検索したところ、STRBPと呼ばれるタンパク質が同定された。STRBPは上皮間葉転換に関連する遺伝子群の選択的スプライシングを制御して上皮型の形態を維持しており、そこに二重鎖HSATII RNAが結合することによって間葉型のスプライシングパターンへの移行が起こることがわかった。
未解明な点の多い反復配列領域、意義解明により治療法開発へつながることを期待
以上のように今回の研究では、本来無機能とされていた反復配列領域の転写産物が、その高度反復という特性ゆえに二重鎖RNAを形成して膵がん細胞の悪性化へ関与していることを示した。「反復配列の分子機能についてはその発現機構や制御法など未解明な点が多く、本研究の成果を礎にしてその病態学的意義が解明され、最終的には発がん予防や新規の治療標的の導出へとつながっていくことが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




