原因不明の線維筋痛症、症状の類似したME/CFSの疼痛発症メカニズムと共通点はあるのか
名古屋大学は1月25日、線維筋痛症で見られる異常な痛みの原因のひとつとして、通常意識にのぼらない固有(深部)感覚の持続的な過興奮が、脊髄内の反射弓に沿って、神経炎症に関わるミクログリアを活性化させ、これにより慢性疼痛が生じていることを脳内の過活動神経回路をトレースできるマウスモデル動物を用いた実験で明らかにしたと発表した。この研究は、同大大学院医学系研究科機能組織学分野の木山博資教授、桐生寿美子准教授、若月康次研究員、常葉大学健康プロデュース学部の安井正佐也准教授らの研究グループによるもの。研究成果は、「Journal of Neuroinflammation」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
線維筋痛症は、身体に炎症や損傷など明らかな原因がないのに、長期にわたって、身体の広い範囲に痛みが持続して起こり、痛み以外に、激しい疲労感、睡眠障害、不安、うつ、認知障害など多彩な症状を伴う原因不明の病気である。近年の研究で、原因は脳や脊髄内の炎症の可能性が示されている。しかし、なぜ脳や脊髄に炎症が生じるのかは不明であり、現在でも効果のある治療法は開発されていない。
線維筋痛症の症状は機能性身体症候群(Functional Somatic Syndrome:FSS)に共通に見られるものが多く、特に筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)の症状と類似している。研究グループは以前、ME/CFSのモデルラットで、過剰な下肢の筋収縮による固有感覚刺激が脊髄の後角でミクログリアを活性化させることを示した。さらにミクログリアの活性化を抑制する薬剤(ミノサイクリン)を髄腔内に投与したところ、動物の異常な痛みは抑制されたことから、「固有感覚誘導性の疼痛」という新たな疼痛発症メカニズムを報告した。今回、このようなメカニズムがME/CFSと同様にFSSに含まれる線維筋痛症でも共通である可能性を検証するため、研究が行われた。
反射弓に沿った神経回路が過活動しミクログリアが活性化した線維筋痛症マウス、薬剤でのミクログリア抑制により疼痛は抑制
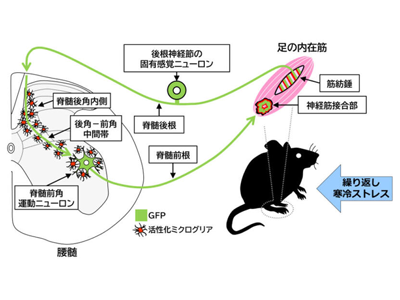
この研究では、線維筋痛症モデルマウスとして知られる、繰り返し寒冷刺激モデルを用いた。昼の間だけ、低温(7℃)と室温を短時間で繰り返す環境下で1週間マウスを飼育すると、長期間にわたる慢性的な疼痛と疲労による活動低下が生じた。一方、このマウスの皮膚や筋、あるいは血液検査をしても、損傷や炎症を示す遺伝子の発現は全く見られなかった。この症状はまさにヒトに見られる線維筋痛症の病態に類似している。
研究グループが開発したAtf3:BAC Tgマウスは、神経の過活動のマーカーとなるATF3という遺伝子の下流でミトコンドリアを標識する蛍光タンパク質(GFP)を発現するマウスである。線維筋痛症モデルに適用すると、過活動が生じている神経細胞のミトコンドリアのみが蛍光で標識される。ミトコンドリアは軸索の先端から樹状突起の先端までニューロンの隅々に存在するため、過活動を起こしたニューロンの全体像を標識できる。従って、このマウスを使うことにより、過活動を起こしている脳内の神経回路を浮かび上がらせることが可能になる。このマウスを解析したところ、足内筋の筋紡錘から後根神経節内の固有感覚ニューロン、脊髄後角から脊髄前角の運動ニューロン、さらには足内筋の神経筋接合部にいたる、いわゆる反射弓に沿った神経回路が蛍光標識された。またそれに沿ってミクログリアが活性化していることが明らかになった。また、このミクログリアの活性化を抑制するために、ミクログリアの分裂増殖を抑制する薬剤を用いて、ミクログリアがこの反射弓に沿って集積しないようにすると、痛みが見られなくなった。
FFSの慢性疼痛に、脳や脊髄のミクログリアを標的とする治療が有効である可能性
線維筋痛症モデルマウスを用いた今回の研究により、線維筋痛症では、無意識のうちに生じる筋緊張が固有感覚の過活動を引き起こし、それが脊髄内でミクログリアの活性化を引き起こすことが明らかになった。また、この活性化したミクログリアが疼痛の原因となることも明らかになった。先に研究グループは、FSSに含まれ線維筋痛症の類縁疾患であるME/CFSのモデルラットを用いた場合も、同様の固有感覚の過活動誘導性の疼痛が生じていることを明らかにしており、今回全く異なる刺激を用いるモデル動物で類似の結果が見られたことから、FSS全般に共通の症状として見られる慢性疼痛は同じようなメカニズムで生じていることを示唆している。従って、FFSの患者に共通に見られる慢性疼痛を和らげる治療には、脳や脊髄に存在するミクログリアを標的とすることが有効である他、一部の筋の過緊張を解除し固有感覚ニューロンの過活動抑制を標的とする新たな治療法が考えられる。「今後は、今回の結果のヒトでの実証と、新たな治療標的に対する効果的な治療法の開発が期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト




