PMP22の異常な発現増加が原因のCMT1A、核酸医薬などでの正常化は困難
東京医科歯科大学は11月28日、シャルコー・マリー・トゥース病(CMT1A)の原因遺伝子・PMP22のゲノム編集を用いた新たな治療方法を開発したと発表した。この研究は、同大難治疾患研究所・神経病理学分野の岡澤均教授、田中ひかり講師、吉岡優希大学院生、ジュリアナ タニグチ ボッソ大学院生(研究当時)、本間秀典特任講師、京都大学の井上治久教授、京都府立医科大学の中川正法名誉教授、横浜市立大学の松本直通教授らの研究グループによるもの。研究成果は、「Communications Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
シャルコー・マリー・トゥース病は、代表的な末梢神経変性疾患であり、日本には1万人に1人程度の患者がいると言われ、指定難病(指定難病10)でもある。この病気のCMT1A型では、17番染色体上のPMP22(peripheral myelin protein 22)遺伝子を含む長いゲノム領域(1.5Mbゲノム領域)が重複して2つ存在するために、PMP22タンパク質量が増加し、このタンパク質の機能が必要であるシュワン細胞が機能失調を起こすのではないかと考えられている。シュワン細胞は、脳脊髄から手足の筋肉に運動の指令を伝えたり、手足の感覚を脳脊髄に伝える末梢神経の働きに必須な細胞であり、シュワン細胞の機能失調は手足の運動感覚障害につながる。シャルコー・マリー・トゥース病患者は、ゆっくりではあるが手足の機能が衰え、生活上の支障を感じることがある。
現時点では、シャルコー・マリー・トゥース病の根本的な治療法はないが、近年では、shRNA、miRNAあるいは核酸医薬などの治療法も実験的に提案されている。しかし、1.5倍程度のPMP22の発現増加を適切なレベルに正常化することは難しく、またPMP22の遺伝子変異による機能低下も同様に常染色体優性の遺伝性末梢神経疾患(Hereditary neuropathy with liability to pressure palsies:HNPP)を発症させることから、治療による過度なPMP22発現抑制は症状悪化につながると考えられる。これまでのshRNAなどの治療法開発では、実験的治療対象として10倍近くPMP22が過剰発現しているトランスジェニックマウスを用いるなど、研究に用いるモデルの適切性にも疑問があった。今回、この問題を解消するため患者由来のiPS細胞を用いて実験を行った。
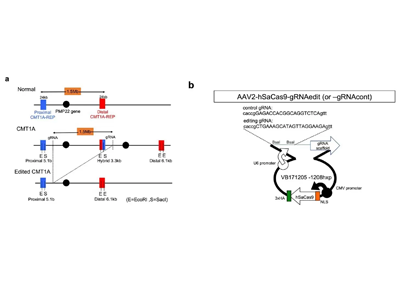
2箇所に切れ目を入れ重複領域含む1.5Mbを切り出すゲノム編集コンセプトを開発
研究グループは、ゲノム編集技術を用い、患者シュワン細胞で3つある1.5Mbゲノム領域を、2つに戻し正常化できないかと考えた。そこで、重複する2つのゲノム領域に共通する特異配列(guide RNA:gRNA)を選び、異常なゲノムでは2箇所に切れ目を入れて、その間にある余分なゲノム領域が切り出されることを狙った。その結果、15~40%の確率で、重複ゲノムの切り出しが狙い通りに生じることを見出した。
患者由来のiPS細胞・iPS細胞由来シュワン細胞で治療効果を確認
次に、その特異配列gRNAとゲノム編集酵素を同時に発現する遺伝子治療ベクターを作成し、これをシャルコー・マリー・トゥース病患者由来のiPS細胞あるいはiPS細胞由来シュワン細胞に投与して、治療効果を検討した。特に、正常者からのiPS細胞由来ニューロンとシャルコー・マリー・トゥース病患者iPS細胞由来シュワン細胞を合わせた培養(normal iPSC-derived neuronとCMT1A-iPSC derived Schwann cellの共培養)では、シュワン細胞が減少して髄鞘化が抑制されていたが、遺伝子治療ベクターをiPS細胞由来シュワン細胞に投与することで、これらの病的変化が軽減した。
ゲノム編集を用いた新しいコンセプトの治療法
今回の研究成果は、シャルコー・マリー・トゥース病について、これまで開発が試みられてきた治療法とは全く異なる、ゲノム正常化という新しいコンセプトの治療法の可能性を示したものと言える。ゲノム編集技術は、現在さまざまな疾患治療への応用が試みられている。その多くは、1から数個、あるいは数10個の塩基変異を正常化することを目的とするものだが、今回の研究から1.5Mb(150万塩基)ゲノム領域の正常化にも用いることが可能であると示した。
低頻度だがオフターゲット効果の可能性、今後の技術改良を目指す
ゲノム編集技術にとどまらず、shRNA、miRNAあるいは核酸医薬などの治療法では、副作用としてオフターゲット効果という事象が考えられる。これにより、目的とする遺伝子以外の関係のない遺伝子もしくは遺伝子発現に影響を与えるリスクがある。今回の研究でも、iPS細胞およびマウス末梢神経にゲノム編集遺伝子治療ベクターを投与した場合のオフターゲット効果を検証した。その結果、非常に低頻度の(生物個体が生きて行く上で体の細胞に自然に起きる遺伝子変異頻度に近いレベル)オフターゲット効果の可能性を認めた。「今後の技術改良によって、さらにリスクを低減するなどして、本コンセプトあるいは本技術の実用化を目指す」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



