ALS発症に重要なMAMの破綻、運動神経の細胞死を引き起こすメカニズムは?
名古屋大学は11月16日、筋萎縮性側索硬化症(ALS)において、小胞体・ミトコンドリア接触領域(MAM)の破綻がALS原因遺伝子産物であるTANK結合キナーゼ1(TBK1)の活性低下を引き起こして、運動神経細胞のストレス応答異常を引き起こすことを解明したと発表した。この研究は、同大環境医学研究所 病態神経科学分野の渡邊征爾講師、山中宏二教授の研究グループと、発生・遺伝分野の荻朋男教授、および同大大学院医学系研究科 神経内科学の勝野雅央教授との共同研究によるもの。研究成果は、「米国科学アカデミー紀要」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
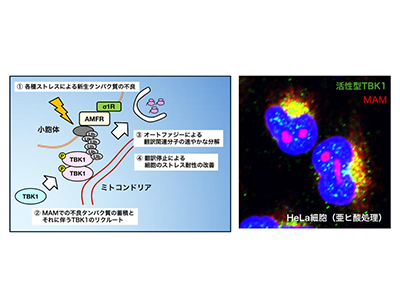
ALSは全身の筋肉が徐々に萎縮して筋力が低下していき、発症から2~5年で死亡する難病だ。しかし根本的な治療法が確立されていないため、早期の病態解明および治療法の開発が望まれている。これまでに研究グループは、運動神経細胞内にある細胞内小器官である小胞体とミトコンドリアが互いに接触する領域、MAMの破綻がALSの発症に重要であることを明らかにしてきた。
MAMは脂質の合成やオートファジーの制御など、多彩な生理機能をもつ、細胞機能制御に重要な領域だ。しかし、MAMの破綻がどのように運動神経細胞の細胞死を引き起こすのかについて、その全容はこれまで明らかにされていなかった。
ALS患者の病変組織・モデルマウスともに「TBK1」活性が顕著に低下
今回の研究を始めるにあたり、研究グループはALS原因遺伝子産物であるTANK結合キナーゼ1(TBK1)に着目した。TBK1は自然免疫に重要な分子で、ウイルスや寄生虫の感染に伴って活性化し、さまざまな炎症反応やオートファジーによる異物の除去を促進することが知られている。一方、近年のゲノム解析技術の発展に伴い、TBK1の機能喪失を引き起こす遺伝子変異がALSの原因となることが示されてきた。
そこで、ALS患者の病変組織においてTBK1の活性がどのようになっているのかを検討したところ、ALSの病変組織ではTBK1の活性が顕著に低下していることを見出した。TBK1は野生型マウスの脊髄では運動神経細胞において強く活性化していたが、ALSモデルマウスの脊髄ではALS患者と同様、顕著に活性が低下していた。
中枢神経組織でのTBK1活性維持にはMAMが必須と判明
このTBK1の活性低下にMAMが影響を与えているのか確認するため、遺伝子欠損によってMAMを破綻させたマウスの脊髄を用いて検討したところ、MAMの破綻したマウスでも同様にTBK1の活性低下が観察された。以上の結果から、中枢神経組織においてTBK1の活性を維持するためにはMAMが必須であることが判明した。
運動神経細胞のストレス応答には、MAM依存的なTBK1の活性化が重要
次に、MAM依存的にTBK1が活性化されるメカニズムの解明に取り組んだ。その結果、培養細胞を亜ヒ酸で処理するとTBK1がMAM依存的に強く活性化されることを見出した。亜ヒ酸は細胞に酸化ストレスを与えることが知られ、タンパク質の構造を異常化させるなどして細胞死を誘導する。細胞はそのようなストレスに対し、ストレス顆粒と呼ばれる構造体を形成し、自身のストレス抵抗性を高めて生存する。
ところが、MAMを遺伝学的に破綻させるかTBK1の機能を薬剤等で強制的に低下させたところ、このストレス顆粒の構成が上手くいかず、細胞のストレス抵抗性が低下して細胞死が生じることが判明した。さらに、MAMの破綻したマウスでは亜ヒ酸を経口摂取させると運動神経細胞の機能が傷害され、運動機能障害を生じることが明らかになった。以上のことから、MAM依存的なTBK1の活性化が運動神経細胞のストレス応答に重要であることが示唆された。
最後に、質量分析を用いた解析を行い、細胞にストレスがかかった際にMAMに合成途中のタンパク質が蓄積することがTBK1のMAMにおける活性化に重要であることを見出した。ストレス時にタンパク質の合成を速やかに停止させ、ストレス顆粒内にタンパク質の設計図であるmRNAを隔離することは、細胞のストレス抵抗性を上げるために重要であることが知られている。TBK1のMAMにおける活性化も、MAMにおいてオートファジーを介したタンパク質の分解を促進してストレス顆粒の形成を助ける役割があることが考えられた。
MAMやTBK1を標的としたALS新規治療法の開発に期待
今回の研究により、MAMがTBK1の活性化を介して運動神経細胞のストレス応答に貢献しており、ALSではMAMの破綻に伴ってTBK1の活性が低下することが運動神経細胞の細胞死につながっていることが示唆された。MAMやTBK1を標的とすることで、将来的なALSにおける新たな治療戦略の開発につながるものと期待される。
「本研究はMAMの細胞内における重要性を改めて示すものだ。細胞内小器官は互いに、特に小胞体との間で物理的に接触し、連携して生理機能を発揮することが近年の研究で明らかにされつつある。MAMも含めた細胞内小器官の接触領域に着目した研究が進展することで、ALS以外の疾患に対する新たな治療法開発にもつながることが考えられる」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト



