インスリンによる細胞増殖・細胞死抑制で、肝がん発症は促進されるのか?
国立国際医療研究センター(NCGM)は11月9日、マウスモデルを用いて糖尿病を伴う脂肪性肝炎では腸におけるインスリン作用が肝細胞がんの発症を防ぐことを明らかにしたと発表した。この研究は、NCGM糖尿病研究センターの植木浩二郎センター長、分子糖尿病医学研究部の添田光太郎研究員、東京大学の藤城光弘教授、小池和彦名誉教授(医学部附属病院消化器内科)、山内敏正教授、門脇孝名誉教授(医学部附属病院糖尿病・代謝内科)、油谷浩幸教授(研究当時、先端科学技術研究センターゲノムサイエンス&メディシン分野)、慶應義塾大学の本田賢也教授(微生物学・免疫学教室)らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
糖尿病はさまざまながんのリスクを上昇させることが知られており、とりわけ肝がんのリスク上昇幅は大きいことが知られている。また、最近、肝がん患者では、非アルコール性脂肪性肝炎(NASH)と呼ばれる糖尿病と関連の強い疾患を合併する人の割合が高くなってきており、NASHを合併する糖尿病の患者においてどのようにして肝がんを予防するかが重要な課題になっていた。
このようなNASHを合併する糖尿病の患者では、肝機能障害や高度のインスリン抵抗性のためにやむを得ずインスリン療法が選択されることも多いが、インスリンは患者の血糖を制御する強力な手段である一方で、細胞増殖作用や細胞死抑制作用もあるので、悪性細胞を増殖させて肝がん発症を促進しかねないと危惧されていた。
しかし、インスリン作用は血糖値の改善のみならず、体内のさまざまな組織の恒常性維持にも重要である。それゆえ、実際にそのような患者でインスリン療法などによる全身のインスリン作用の強化で肝がん発症が促進されるのかどうかについては議論が続いていた。また、そのメカニズムについても明らかにされていなかった。
予想に反し、糖尿病合併NASHマウスにインスリン治療で肝発がん抑制
研究グループは、出生直後にストレプトゾトシンを少量投与し、離乳時から高脂肪食を与えることによって、糖尿病、NASH、肝細胞がんを同時に発症する疾患モデルマウスであるSTAM(STelic Animal Model)マウスを採用し、これにインスリンまたはフロリジンのどちらかを投与して予後を比較した。インスリンを投与すると血液中のインスリンが増加するとともに血糖値が低下するが、フロリジン(SGLT1/2阻害薬)はグルコースの尿中排泄を促進するため、血液中でインスリンを増加させずに血糖値を改善する。このことから、両者の予後の違いは血糖値によらないインスリン作用を表すものとして解釈できる。
この実験ではインスリン投与による肝発がん増加が懸念されたが、意外にもインスリン投与で肝発がんが抑制され、フロリジン投与では抑制されなかった。このことは、全身へのインスリン投与が肝発がんを防ぐ可能性を示唆している。
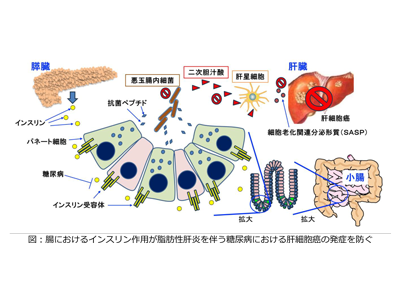
インスリン投与で二次胆汁酸の貯留低下・腸内細菌叢の異常改善・腸管の抗菌ペプチド発現増加
そこで、まずは肝臓でがんのない部分を解析したところ、インスリンを投与すると、二次胆汁酸の貯留が低下していた。二次胆汁酸は高脂肪食のもとで肝星細胞から細胞老化関連分泌形質(SASP)を増加させ、肝発がんを促すと考えられており、腸内細菌で代謝されて生成するため、引き続き腸内細菌叢を解析すると、STAMマウスで認められた腸内細菌叢の異常がインスリン投与により改善していた。他方、STAMマウスではインスリン投与で腸管における抗菌ペプチドの発現が増加しており、これによる悪玉腸内細菌の抑制が腸内環境の改善に役立った可能性が考えられた。以上のことから、インスリンは腸に作用して腸内環境を改善することで肝発がんを抑制している可能性が考えられた。
また、糖尿病を合併したNASHの患者では、インスリンを使用している患者で同様の腸内細菌叢の違いが示唆されたので、臨床的にもこの仮説が有効である可能性が示唆された。
糖尿病合併のNASHマウス、腸内細菌叢の異常が肝発がんに関与した可能性
そして、STAMマウスでは、長期間抗菌薬を投与して腸管内にほとんど細菌がいない状態にしたり、短期間抗菌薬で処置した後に正常マウスから糞便菌叢移植を実施して腸内細菌叢の異常を是正したりすると、肝発がんは抑制された。このことからSTAMマウスでは腸内細菌叢の異常が肝発がんに関与している可能性が示唆された。
腸上皮のみでインスリン受容体欠損のマウス、インスリン投与しても肝発がん抑制されない
以上のことから、STAMマウスの肝発がんがインスリン投与によって抑制されたのは、腸におけるインスリン作用の不足が補われたことが一因である可能性が考えられた。そこで、研究グループは腸上皮のみでインスリン受容体を欠損するマウス(intestinal epithelial insulin receptor knock out:ieIRKO)を作製し、ieIRKOマウスに対しSTAMマウスにする処置を施し、このieIRKO-STAMマウスにインスリンを投与した。ieIRKO-STAMマウスでは全身のうち腸上皮だけでインスリンが作用しなくなるが、これにより抗菌ペプチドの発現がインスリン投与によって増加しなくなり、肝発がんも抑制されなくなったことから、STAMマウスでは腸のインスリン作用の不足が肝がん出現の一因であることが明らかになった。
しかし、上述の通りSTAMマウスの作製にはストレプトゾトシンという変異原性物質が用いられており、実際に研究グループも肝臓に広範に体細胞変異が誘導されていることを確認した。つまり、STAMマウスでは肝臓の多くの細胞に変異があるため、早期かつ極めて高率に肝がんを発症していると考えられる。
ieIRKOマウス、長期間の高脂肪食給餌も肝発がん促進
そこで研究グループは、ヒトのように長期間かけて発がんするモデルとして、上記のieIRKOマウスに長期間高脂肪食給餌のみ行った。この条件においてもieIRKOマウスでは腸において抗菌ペプチドの発現が低下し、肝発がんが促進されたことから、やはり腸上皮のインスリン作用の不足は肝発がんを促進すると考えられた。
腸のインスリンシグナルとその下流因子、糖尿病合併NASH肝発がんの治療標的となる可能性
STAMマウスはインスリン抵抗性をインスリン分泌亢進で代償することができず、顕著な高血糖を来している糖尿病モデルマウスであり、欧米の高度肥満の糖尿病の患者より、日本人や東洋人のように軽度の肥満で発症する糖尿病の患者によく似ていると言える。以上の研究結果から、NASHを合併する糖尿病の患者では、適切にインスリンを補充することで腸におけるインスリン作用を補い、NASH肝がんの発症を予防できる可能性があり、腸のインスリンシグナルとその下流因子は糖尿病合併NASH肝発がんの新たな治療標的となる可能性があることが示唆された。
一方で、今回の研究は主にモデルマウスにおける検証であり、ヒトの患者にこの知見が応用できるかどうかは今後の検証が必要であると、研究グループは述べている。
▼関連リンク
・国立国際医療研究センター プレスリリース




