抗がん剤などにより形成促進されるp62/NBR1液滴、その細胞機能について解析
東北大学は11月1日、がん細胞の転移を強力に抑制するチロシンキナーゼ阻害薬(TKIs)を発見し、そのメカニズムについて解析したと発表した。この研究は、同大大学院薬学研究科の野口拓也准教授、関口雄斗博士、島田竜耶大学院生、松沢厚教授らの研究グループによるもの。研究成果は、「米国アカデミー紀要(Proceedings of the National Academy of Sciences)」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
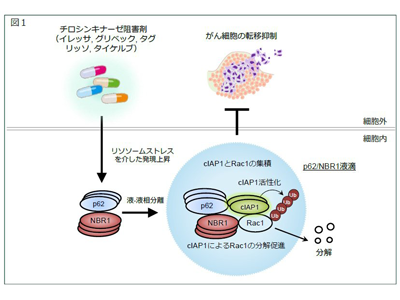
液−液相分離によって形成される分子凝集構造体(液滴)は、「膜のないオルガネラ」とも呼ばれ、細胞内で特定のタンパク質を濃縮することで、より効率的なシグナル伝達を可能にしていることが発見され、近年、その構造や機能の解析が盛んに行われている。研究グループは最近、抗がん剤や抗菌薬などの薬剤が、シグナル伝達分子であるp62およびNBR1の液−液相分離を引き起こすことで、液滴(p62/NBR1液滴)の形成を促進することを発見し、これら薬剤によって誘導されたp62/NBR1液滴の細胞機能についての解析を行っている。
イレッサなどのTKIsがp62/NBR1液滴を促進、液滴内でcIAP1がRac1を分解
研究グループは、TKIsが誘導するp62/NBR1液滴の機能を解明することを目的に研究を行った。イレッサ、グリベック、タグリッソ、タイケルブなどのTKIsはリソソームを刺激する(リソソームストレスを誘導する)ことでp62/NBR1液滴の形成を促進した。一方、タセルバ、インライタ、ヴォトリエントなどのTKIsはp62/NBR1液滴の形成を促進できなかった。
そこで、p62/NBR1液滴の形成を促進するTKIs(イレッサなど)を用いて、p62/NBR1液滴の解析を行った。イレッサが誘導したp62/NBR1液滴を解析すると、p62/NBR1液滴の中にがん細胞の転移を促進するタンパク質であるRac1とその分解酵素cIAP1が包含されていることが判明した。さらに、p62/NBR1液滴の中で、cIAP1によるRac1の分解が誘導されていることを突き止めた。この結果から、イレッサはp62/NBR1液滴の中でRac1の分解を促すことでがん細胞の転移能を低下させていることが示唆された。
肺転移モデルマウスでも、イレッサによるp62/NBR1液滴を介した転移抑制作用を確認
また、p62/NBR1液滴の形成を阻害するとイレッサによる転移抑制作用が消失したことから、イレッサによる転移抑制にはp62/NBR1液滴が重要であることが判明した。さらに、イレッサによる転移抑制作用におけるp62/NBR1液滴の重要性は、肺転移モデルマウスの解析により生体内でも確認された。以上より、イレッサ、グリベック、タグリッソ、タイケルブなどのリソソームを刺激するTKIsは、p62/NBR1液滴を介したRac1の分解により、がん転移を阻止するという、全く新しいメカニズムが明らかになった。
抗がん剤耐性、転移リスクの高いがんに有効である可能性
イレッサ、グリベック、タグリッソ、タイケルブは、それぞれ特定のチロシンキナーゼを特異的に抑制する分子標的薬としてがん治療に活用されている。今回の研究により、これらのTKIsは、本来の標的であるチロシンキナーゼの抑制とは全く別のメカニズムでがん細胞の転移を抑制することが明らかとなった。つまり、これらのTKIsは、現在の適応だけでなく、多種多様ながんの遠隔転移を抑制する転移抑制剤として転用できる可能性がある。また、cIAP1は遺伝子増幅によりがん細胞で発現量が増えることが報告されている。cIAP1の発現量が高いがん細胞は、抗がん剤に耐性を示すことが多く、転移の危険性の高いがんと言える。従って、TKIsによる転移抑制作用は、転移の危険性の高いがんにこそ有効である可能性がある。「研究の成果は、p62/NBR1液滴を介した転移抑制という、全く新しいコンセプトを持つ革新的な転移抑制剤の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース




