複数の神経学的合併症を伴う慢性腎臓病、認知症を引き起こす分子メカニズムは未解明
東京医科歯科大学は10月25日、これまで不明だった、慢性腎臓病(CKD)による認知機能低下の分子メカニズムの一端を解明したと発表した。この研究は、同大大学院医歯学総合研究科腎臓内科学分野の内田信一教授、萬代新太郎助教、松木久住大学院生、精神行動医科学分野の髙橋英彦教授、塩飽裕紀テニュアトラック准教授らの研究グループによるもの。研究成果は、「Aging(Albany NY)」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
進化の過程で、ヒトの腎臓は、循環血液のクレンジング(老廃物の尿中排泄)機能にとどまらず、電解質・ミネラルや血圧を調整し、赤血球を産生させるホルモン(エリスロポエチン)を作る、骨を強化するなど、忙しく働く生命の維持に重要な臓器となった。その分年齢を重ねるにつれて、また高血圧や糖尿病などの疾患によって衰えることで、CKDはヒトにとって非常に身近な病気になった。自覚症状を起こさないまま静かに進行し、国内の1300万人以上(成人の約8人に1人、高齢者の約3人に1人)、世界の7億人以上が罹患するとされている。
CKDは、やがて透析を必要とする前段階から、全身の臓器に影響を及ぼすことがわかってきた。研究グループはこれまで、CKDに潜在する複雑病態・multi-morbidity(多併存症)を克服するための研究や、CKDによる血管障害などの腎外臓器合併症(臓器連関)のメカニズムを科学的に解明して治療開発につなげるための研究を行ってきた。
CKDは、睡眠障害、気分障害、むずむず足症候群、認知機能障害などさまざまな神経学的合併症を引き起こすことが知られている。特に認知症については、推算腎機能を示すeGFRの低下やアルブミン尿が独立したリスク因子と報告されており、最近の大規模な観察研究でも、認知症の原因として10%程度がCKDで説明できるとされる。しかしながら、CKDによって認知症が起こりやすくなる分子メカニズムは十分にはわかっていなかった。
とりわけ認知症の代表格であるアルツハイマー病では、アミロイドβやタウなどのタンパク質が不溶化、蓄積することがその病態の根幹をなすと考えられているが、病初期には血液脳関門(blood-brain barrier、BBB)の破綻が起こっていることも注目されている。BBBは循環血液と中枢神経系を隔てる構造物で、アミノ酸、グルコースのような脳にとって重要な栄養素などをのぞいて、自由な物質透過を許さないゲートキーパーである。BBBが機能障害を起こすことは疾患の発症につながる一方で、中枢神経系の治療薬がBBBを超えて脳に移行しやすくさせる創薬研究も非常に重要である。従って、BBBの透過性が変化するメカニズムの解明は、2つの側面から重要な意味を持つ。研究グループは今回、認知症の病態理解のため、新たな切り口で、CKDによって脳血管の障害と神経変性の分子病態が惹起される可能性に着目した。
樹立したCKDマウス、脳に不溶性のタウタンパク質などの増加を確認
研究グループはまず、CKDを発症する疾患モデルマウスを樹立し、CKDマウスの近時記憶力が低下することを行動実験で示した。次に、アルツハイマー病を始めとした神経変性疾患ではさまざまな不溶化タンパク質の蓄積が起こることを踏まえて、健康的な腎臓を持つマウスとCKDマウスのそれぞれから脳の海馬を抽出した。塩溶と塩析によって可溶性分画と不溶性分画とに分け、各々でプロテオーム解析を行った。CKD脳の不溶性プロテオーム解析を行った結果、アルツハイマー病でもみられる、不溶性のタウタンパク質やRNAスプライシングに関連したタンパク質群が増加することがわかった。ウエスタンブロッティングによる検証では、海馬、大脳皮質でも不溶化したリン酸化タウタンパク質がCKDマウスで増加していることが確認された。
CKDマウスではIgGが血液中からBBBを超えて脳実質に流入
プロテオーム解析のもうひとつ着目すべき所見として、可溶性および不溶性分画ともに、免疫グロブリンの重鎖がCKDマウス群で増加していることが明らかとなった。これはBBBの機能障害によって、物質の透過性が亢進することを示唆する所見である。ウエスタンブロッティングで免疫グロブリンG(IgG)がCKD脳で増加することが確認できた。脳内で作られるIgGのメッセンジャーRNA発現量に差は無く、血液中のIgG濃度にも差はなかったことから、IgGは血液中から脳実質に流入することがわかった。血液を灌流して除いた上で蛍光免疫染色を実施したところ、CKDマウス脳では脳間質の血管内皮細胞下にIgGが沈着しており、外因性に投与したエバンスブルー色素とも部分的に一致していた。これらの結果から、CKDを罹患したマウスではBBBの機能障害が起きた結果、IgGやエバンスブルー色素がBBBを超えて脳に漏出したと考えられた。
BBBの密着結合と接着結合を担うタンパク質量、尿素によるMMP2の活性化により低下
BBBの主な構成細胞の血管内皮細胞は、上皮細胞(組織の表面側にある細胞の総称)とも呼ばれる。上皮細胞は一般的に密着結合(タイトジャンクション、TJ)と接着結合(アドヘレンスジャンクション、AJ)が共同して、互いに細胞の側面を強く接着させてバリアを作る。BBBでも重要な構造である。蛍光免疫染色を行うと、TJ構成タンパク質であるクローディン5、AJ構成タンパク質であるPECAM-1(CD31)、基底膜の構成タンパク質である4型コラーゲンの発現量が、いずれもCKDマウスで低下していた。このメカニズムを追究すべく、マウス脳血管内皮細胞(bEnd.3)を使って尿毒症性物質を複数投与した。すると、尿素の投与によって、用量依存的にクローディン5やCD31のタンパク質発現量が低下した。研究グループは、クローディン5、CD31、4型コラーゲンなどのBBB構成タンパク質群を基質に持つタンパク質分解酵素MMP(matrix metalloproteinase、MMP)、特に不溶性プロテオーム解析でもヒットしたMMP2に着目した。CKDマウスの血清投与下に培養したbEnd.3細胞では、ゼラチンザイモグラフィーを行うとMMP2の活性亢進が確認され、蛍光免疫染色では、CKDマウス脳の血管内皮細胞のMMP2発現量が増加していることがわかった。bEnd.3細胞で、尿素投与により低下したクローディン5のタンパク質発現量は、MMP阻害薬投与で改善することも確認された。これらの結果から、尿素によるMMP2の活性化に伴うBBB構成タンパク質群の分解が、CKDにおけるBBB透過性亢進に関与していることが明らかになった。
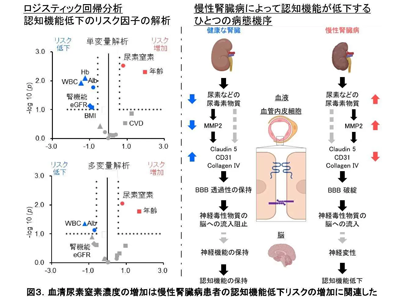
CKD患者980人で認知機能低下リスク因子を分析、BUN上昇・低栄養状態などがリスクと判明
最後に、研究グループは、実際のCKD患者の認知機能低下のリスク因子を明らかにすることにした。980人のCKD患者を対象に、認知機能低下の有無を目的変数として多変量ロジスティック回帰分析を実施した。性別、年齢や体格body mass indexや糖尿病、心血管病の有無を調整因子として補正したところ、eGFRは認知機能低下の有意なリスク因子とは言えなかった一方で、血清尿素窒素濃度の上昇や低栄養状態(血清アルブミン濃度低下)などが認知症の強力なリスク因子とわかった。このことから、腎臓の純粋なろ過機能そのものよりも、尿素、その他の尿毒症性物質の蓄積が2次的に認知機能低下に関わることが示唆された。これはある時点での横断的な観察研究結果のため因果関係を示したものではないことに注意が必要だが、今回の研究結果から得られた新たな認知症のひとつのメカニズムを、さらに詳細に解明し治療開発に生かすことが重要と考えられる。
BBB物質透過性の新メカニズム、神経変性疾患などの治療開発や創薬に寄与する可能性も
今回の研究は、CKD脳において血液脳関門の機能障害と不溶化タウタンパク質の蓄積といった神経変性疾患と類似の変化が起きていることと、尿素が重要な因子として関与することを明らかにした。BBBの物質透過性について新たなメカニズムがわかった事は、BBBの機能障害を起こすさまざまな疾患(アルツハイマー病を始めとした神経変性疾患やてんかんなど)の病態理解や治療開発、逆にBBBを透過しやすい創薬に寄与する可能性がある。
血液中の尿素窒素濃度の上昇は、CKDとCKD状態下のタンパク質の過剰摂取、CKDが無い場合も脱水症などで引き起こされることが多い。このため、夏季を中心に脱水状態を未然に防ぐことや、CKD患者におけるタンパク質摂取制限、透析患者における透析効率の強化などが、尿素の血中濃度上昇や体内蓄積を軽減する事ができるため、ひいてはCKDによる血管障害や認知機能低下を予防するひとつの治療法につながる可能性がある。
今回の知見は、動物実験を中心に得られた知見である点、尿素以外の尿毒症性物質の影響をすべて解析したものではない点が、主な課題点である。「尿素は確かにCKD環境下で血清濃度が上昇し、体内に蓄積する物質である一方で、生物の進化の過程で獲得、活用されてきたアンモニアを解毒するための重要な物質である。尿素が毒性を持つのか、それはどの文脈なのか(CKD環境下のみなのか)、再考を促す研究結果も散見されるようになった。さらなる研究によってこの問いの答えを発見することが、将来の診療への応用につながると期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



