2021年承認のPDE4阻害薬、治療効果の詳細メカニズムは不明だった
東京医科歯科大学は10月13日、アトピー性皮膚炎の治療薬ジファミラストが希少な免疫細胞である好塩基球からのインターロイキン4(IL-4)産生を阻害することで、マウスモデルの症状を改善していることを突き止めたと発表した。この研究は、同大高等研究院炎症・感染・免疫研究室の髙橋和総大学院生、三宅健介特任助教、伊藤潤哉大学院生、烏山一特別栄誉教授と人体病理学分野の大橋健一教授ら、北里大学医学部免疫学単位の島村雛乃大学院生、末永忠広教授との研究グループによるもの。研究成果は、「Journal of Investigative Dermatology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
アトピー性皮膚炎は、慢性的、持続的なかゆみや湿疹を特徴とする慢性皮膚疾患。特に、30歳台までの有病率が約10%と高く、患者のQOL低下や医療費負担の増加が社会的に問題となっている。アトピー性皮膚炎の病態には未だ数多くの不明点が残されているが、最近の研究からIL-4などの2型サイトカインが皮膚炎症状に大きく関与していることが明らかになってきた。アトピー性皮膚炎の治療は、保湿剤などを用いたスキンケア、抗ヒスタミン薬の内服、ステロイド外用薬やタクロリムス軟膏などを用いた抗炎症療法が中心だったが、最近炎症に関わる原因分子そのものを標的とした医薬品による治療が可能になってきた。
PDE4は細胞の機能を制御するサイクリックAMPの分解酵素。PDE4阻害薬であるジファミラストは、細胞内でPDE4によるサイクリックAMPの分解を阻害することで、細胞内のサイクリックAMPの濃度を上昇させ、炎症細胞からの炎症性サイトカインの分泌を抑える作用を持つと考えられている。特に、アトピー性皮膚炎では臨床研究の結果、軽症から中等症のアトピー性皮膚炎患者に対するPDE4阻害薬の有効性が認められ、2021年にジファミラストが治療薬として承認された。しかし、アトピー性皮膚炎においてPDE4阻害薬がどのような細胞を標的として治療効果を示しているのかはよくわかっていない。そこで、アトピー性皮膚炎マウスモデルを用い、ジファミラストの標的細胞について検討を行った。
希少な免疫細胞「好塩基球」からのIL-4産生阻害でアトピー性皮膚炎改善
研究グループは、まずアトピー性皮膚炎マウスモデルに対するジファミラスト軟膏の効果を検討。マウスの耳にハプテンであるオキサゾロンを毎日塗布することでアトピー性皮膚炎を引き起こした。炎症が顕著となった時点(炎症誘導の4日後)からジファミラスト軟膏を毎日塗布したところ、肉眼像が改善され、皮膚における炎症細胞の数も減少。以上から、ジファミラスト軟膏はアトピー性皮膚炎マウスモデルに対して治療効果を持つことが解明された。
続いて、ジファミラストの塗布により炎症を起こした皮膚におけるIL-4の量が減少することを見出した。そこで、ジファミラスト軟膏の治療効果は皮膚におけるIL-4産生を抑制することによるためではないかと考え、IL−4欠損マウスを用いた実験を行った。その結果、ジファミラスト軟膏の治療効果はIL-4欠損マウスでは見られなくなることがわかった。
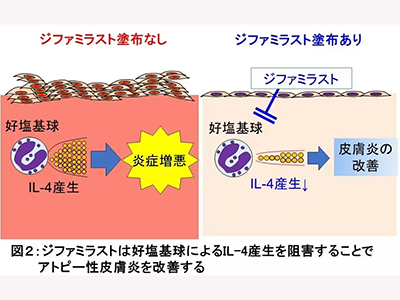
さらに、同モデルにおけるIL-4の産生細胞を検討。希少な免疫細胞である好塩基球が、皮膚における主要なIL-4産生細胞であることがわかった。そこで、好塩基球を除去したマウスや好塩基球特異的にIL-4を欠損したマウスを用いてジファミラストの効果を検討したところ、これらのマウスでもジファミラストの治療効果は認められないことがわかった。以上から、ジファミラストは好塩基球からのIL-4産生を抑制することでアトピー性皮膚炎への治療効果を示すことが解明された。
ジファミラスト、ERKシグナル経路を一部抑制で好塩基球からのIL-4産生を抑制
最後に、研究グループはジファミラストが好塩基球によるIL-4の産生を直接阻害するのかを試験管内で検討。その結果、ジファミラストはさまざまな刺激により活性化した好塩基球からのIL-4産生を抑制することが明らかになった。さらに、RNAシーケンス解析により、ジファミラストを添加した好塩基球の遺伝子発現を網羅的に解析したところ、ジファミラストはERKシグナル経路を一部抑制することで好塩基球からのIL-4産生を抑制することが示唆された。
好塩基球がアトピー性皮膚炎の有望な治療標的となる可能性
研究グループは、ジファミラストが好塩基球からのIL-4の分泌を阻害することでアトピー性皮膚炎を改善していることをマウスモデルにより解明した。今回の研究はマウスモデルを用いた知見だが、実際のアトピー性皮膚炎患者の皮膚でも、好塩基球が浸潤していることが報告されている。このことから、患者においても今回の研究と同様のメカニズムによってジファミラストの皮膚炎症が改善されている可能性が十分考えられるという。同研究から、ジファミラストによる治療効果に希少細胞である好塩基球が関与する可能性が提示された。このことは、臨床におけるジファミラストの適用を考える上でも重要な知見となると考えられる。さらに、同研究から、好塩基球や好塩基球の産生する分子がアトピー性皮膚炎の有望な治療標的となることが示唆され、今後の開発の伸展が期待される、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




