従来の光センサータンパク質、強い光でないと反応できず実用化に課題
慶應義塾大学は10月16日、独自の光センサータンパク質「キメラロドプシン」を用いて、光遺伝学を利用した高感度な視覚再生効果および網膜変性の保護効果を、世界で初めてマウスで確認したと発表した。この研究は、同大医学部眼科学教室の栗原俊英准教授、堅田侑作特任助教らの研究グループによるもの。研究成果は、「iScience誌」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
網膜色素変性症をはじめとする遺伝性網膜疾患は、未だ治療法のない主要な失明疾患だ。世界で200万人以上がこの疾患で苦しんでいるとされている。そのため、近年さまざまな技術を応用した治療法の開発が活発に進められている。その1つが光遺伝学(オプトジェネティクス)だ。これを応用して患者の目の中で働くことのできる光センサー遺伝子を送り込み、視覚を再生できることが知られており、現在海外では治験も複数行われている。しかし、従来の光センサータンパク質は直射日光のような非常に強い光でないと反応できず、実用化に課題があった。そこで今回は、名古屋工業大学の神取秀樹教授らが創出した「キメラロドプシン」を用いて、高感度な視覚再生遺伝子治療法として応用する研究を行った。
「キメラロドプシン」で高感度視覚再生・網膜変性保護効果
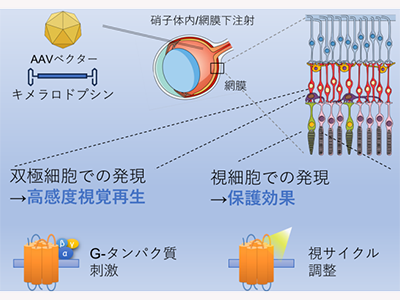
今回の研究では、網膜色素変性のモデルマウス(rd1)に対して、キメラロドプシンをコードする遺伝子を搭載したAAVベクターを硝子体内へ投与し治療する実験を実施した。無治療マウスでは光応答が無いのに対し、治療マウスでは強い光はもちろん、街灯のある夜道程度の弱い光でも反応が確認された。さらに、同じウイルスベクターを網膜下投与で視細胞に発現させたところ、無治療マウスに対し、治療したマウスでは網膜変性の進行抑制効果を確認した。
同研究では、動物型と微生物型のロドプシンを組み合わせてキメラにすることにより、高感度と視サイクル不要で働くという特徴を両立。これをAAVベクターに搭載し、網膜双極細胞で発現させることにより高感度な視覚再生効果、視細胞で発現させることにより網膜変性の保護効果を確認した。
視覚再生遺伝子治療実用化への応用に期待
今回の研究成果は今後、視覚再生遺伝子治療の実用化に応用されることが期待される。同研究室では臨床応用に向けてさらなる研究開発を進めている、としている。
▼関連リンク
・慶應義塾大学 プレスリリース




