新規治療法開発に向け、細胞レベルでの病態再現が課題
京都大学iPS細胞研究所(CiRA)は9月28日、ヒトiPS細胞由来腎オルガノイド用いてアルポート症候群の病態モデルを開発し、創薬候補物質の選択に有用であることを確認したと発表した。この研究は、同センターの平山隆一郎共同研究員(当時:増殖分化機構研究部門、大正製薬株式会社)、CiRA同部門の長船健二教授ら、神戸大学大学院医学研究科、兵庫県立こども病院の研究グループによるもの。研究成果は、「Communications Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
アルポート症候群は、腎機能に重要な糸球体基底膜を構成するIV型コラーゲン遺伝子COL4A3、COL4A4およびCOL4A5の異常に起因し、20〜30代と比較的早期に末期腎不全に陥る。その後は透析療法が必要となることから患者の生活を大きく制限し、費用も高額であることから経済的にも大きな負担となっている。降圧薬などが治療に有効であると報告されているものの、病態進行を完全に停止することは難しく、有効な治療法の開発が待ち望まれている。一方で、腎臓は血液をろ過するために複雑な構造からなり、その機能に重要な糸球体基底膜の異常などアルポート症候群の病態を細胞レベルで再現することは難しく、有効な新規治療法開発に向けた課題となっている。
アルポート症候群患者から疾患特異的iPS細胞を樹立
さまざまな組織に分化することのできるiPS細胞を用いて、種々の臓器を模倣したオルガノイドの作製方法が研究されている。これらのオルガノイドは、いずれも臓器特徴的な機能や構造など従来の細胞株では不可能であった性質を再現できる可能性がある。
今回の研究では、アルポート症候群新規治療法の探索に有用な技術開発を目指し、アルポート症候群患者から疾患特異的iPS細胞を樹立した。これらのiPS細胞から作製した腎オルガノイドはアルポート症候群様の病態を示した。患者由来iPS細胞による腎オルガノイドをアルポート症候群の疾患モデルとして用いて、低分子化合物4-PBAが異常コラーゲンの構造を修正する可能性を見出し、新規治療法の探索に有益であることを確認した。
まず健常人由来iPS細胞で腎オルガノイド作製法を検討、α5(IV)発現と沈着部位を確認
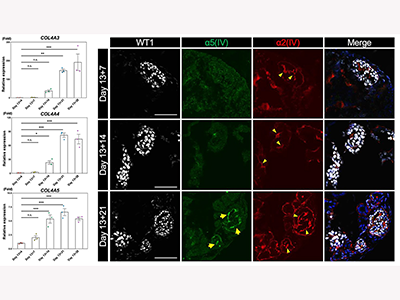
IV型コラーゲンは3本のα鎖で構成されており、各鎖が巻き付き合い三重らせん構造のトリマー(三量体)を形成する。生体において、α5(IV)は胎児期の未熟な糸球体基底膜には存在せず、臓器の発達に伴ってα3鎖、α4鎖およびα5鎖がヘテロトリマー(ヘテロ三量体)となり糸球体基底膜を構成することが知られている。α5(IV)を発現する腎オルガノイドの作製は、アルポート症候群の病態を模倣するために必須だ。
研究グループは、健常人由来iPS細胞を用いて腎オルガノイドの作製方法を検討することで、時間依存的にCOL4A5遺伝子の発現が上昇し、その遺伝子産物であるα5(IV)が腎オルガノイドの糸球体基底膜様構造上に沈着することを確認した。これらの結果は、腎オルガノイドが生体の腎臓の成熟した糸球体基底膜と類似していることを示している。
患者iPS細胞由来腎オルガノイドはα5(IV)欠損
次に、COL4A5遺伝子に変異のある軽症型および重症型のアルポート症候群患者2人からiPS細胞を樹立し、上記の方法を用いて腎オルガノイドを作製した。患者由来iPS細胞から作製した腎オルガノイドにおける糸球体基底膜様構造のα5(IV)を調べたところ、臨床病態と同様にタンパク質発現を欠損していた。一方で、軽症型のCOL4A5遺伝子変異を正常型に修復したiPS細胞から作製した腎オルガノイドでは糸球体基底膜様構造にα5(IV)の発現を認めた。このことから、患者由来iPS細胞から作製した腎オルガノイドは、アルポート症候群の病態を再現していると考えられる。
患者由来腎オルガノイド、軽症・重症型の特徴をそれぞれ反映
糸球体基底膜のⅣ型コラーゲンは、主にα3鎖、α4鎖、α5鎖が巻き付いたα3α4α5(IV)ヘテロトリマーにより構成される。典型的な重症型のアルポート症候群患者ではCOL4A5遺伝子のみの変異であっても、α3α4α5(IV)ヘテロトリマーが形成されないためα5(IV)だけでなくα3(IV)およびα4(IV)も同様に糸球体基底膜から欠損する。一方で、非典型的な軽症型の患者では、COL4A5遺伝子変異を有するものの、α3鎖、α4鎖、そして構造異常を呈するα5(IV)がヘテロトリマーを形成し、糸球体基底膜に存在する。そのため、非典型的なアルポート症候群患者の糸球体基底膜では健康な人と同様にα3(IV)およびα4(IV)を検出可能だ。今回の研究で作製した腎オルガノイドもこの特徴を反映しており、軽症型iPS細胞から作製した腎オルガノイドではα3(IV)が検出できる一方で、重症型では検出できなかった。このことから、腎オルガノイドを用いて、アルポート症候群患者の個人間の病態の差異を再現することができたと考えられる。
4-PBA添加で軽症型iPS細胞由来腎オルガノイドのα5(IV)を検出
タンパク質の構造異常は、特定の低分子化合物により修復できることが知られている。アルポート症候群のIV型コラーゲンの構造異常に対しても低分子化合物が作用する可能性を検証するため、軽症型iPS細胞から作製した腎オルガノイドに、構造異常を修復する可能性の報告されていた低分子化合物の4-PBA、TMAO、mannitolを添加し、α5(IV)の発現の有無を調べた。その結果、4-PBA添加群でα5(IV)を検出した。この結果から、アルポート症候群においても、低分子化合物を用いてタンパク質の構造異常を修復する「ケミカルシャペロン療法」が新たな治療法となりうることが示唆される。
ケミカルシャペロン療法が有効な可能性
今回の研究では、アルポート症候群の患者から樹立したヒトiPS細胞由来の腎オルガノイドが、アルポート症候群の病態を再現する培養系の疾患モデルとなることを示した。さらに、今回開発した疾患モデルを使用して、タンパク質の構造異常を修復するケミカルシャペロン療法が有効である可能性を示した。同研究成果により、アルポート症候群を標的とした新規治療法の開発や病態の解明、非侵襲的な診断方法の開発が進み、患者が安心して受けることのできる新たな医療の実現につながることが期待される、と研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース



