有効な治療薬のないリピート伸長病、課題残るASO以外の新しい創薬基盤を検討
熊本大学は9月27日、「ピロール・イミダゾール(PI)ポリアミド」がリピート伸長病の新しい創薬基盤になることを発見したと発表した。この研究は、同大医学研究所ゲノム神経学分野の塩田倫史教授らの研究グループによるもの。研究成果は、「The Journal of Clinical Investigation」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
リピート伸長病は、特定のDNA塩基配列の繰り返し(リピート配列)が異常に長くなることで引き起こされる疾患群の総称である。現在までに、50以上のリピート伸長病が発見されており、それらの多くは神経・筋に病変をきたす難病である。例えば、「CAGリピート伸長」はハンチントン病・脊髄小脳失調症・球脊髄性筋萎縮症など、「CTGリピート伸長」は筋強直性ジストロフィー1型などの発症要因となる。
これまでにリピート伸長病に対する治療法は、化合物による薬理学的治療・幹細胞を用いた治療・遺伝子治療などの開発が進んでいるが、現在のところ有効な治療薬はない。ハンチントン病に対しては、病原性となるRNAを除去するアンチセンスオリゴヌクレオチド(ASO)を用いた臨床試験が近年実施されたが、治療効果が認められず中止された。治療効果が認められなかった原因には、ASOが病原性RNA以外の正常なRNAを除去してしまう「オフターゲット効果」、あるいはASOが脳の適切な領域に到達しない「低い細胞膜透過性」などが考えられている。研究グループは、これらの課題を解決する新しい創薬基盤の創出を目指して「PIポリアミド創薬」を検討した。
ハンチントン病と筋強直性ジストロフィー1型に対するPIポリアミドの効果を解析
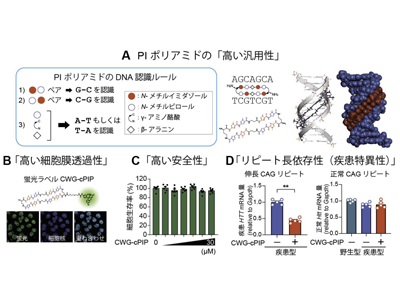
PIポリアミドは、アミド結合したN-メチルピロールとN-メチルイミダゾールから構成される化合物である。PIポリアミドは、任意のDNA配列に最適化して合成することができ、標的とするDNAの副溝に対して特異的に結合する。今回の研究では、CAG/CTGリピートDNAに結合するPIポリアミドのひとつである「CWG-cPIP」が、ハンチントン病および筋強直性ジストロフィー1型患者由来細胞と各疾患モデルマウスにおける神経機能の低下を改善するか、薬理学的解析を行った。
高い選択性と結合親和性を示す「CWG-cPIP」、患者由来細胞でRNA凝集体の産生を抑制
まず、標的DNAに対するCWG-cPIPの選択性と結合親和性を核酸熱安定性解析で調べた。結果として、CWG-cPIPはCAG/CTGリピートが形成する二本鎖DNA構造に加えて、リピート伸長病で形成されるDNAのエラー構造(ミスマッチDNA構造)に対しても高い選択性と結合親和性を示した。また、CWG-cPIPはCAG/CTGリピートDNAの長さに正相関しRNAポリメラーゼの転写を阻害することが明らかになった。
次に、病原性CAG/CTGリピートDNAを持つ疾患由来の細胞を用いてCWGcPIPの有効性を評価した。研究グループは、「CAGリピート伸長病」であるハンチントン病と「CTGリピート伸長病」である筋強直性ジストロフィー1型に着目した。ハンチントン病の病態発症は、主に伸長CAG RNAの翻訳産物の凝集体「ポリグルタミン;polyQ」の細胞内蓄積に起因すると考えられている。一方、筋強直性ジストロフィー1型の病態発症は、主に伸長CUG RNAの凝集体の細胞内蓄積に起因すると考えられている。今回、患者由来の線維芽細胞にCWG-cPIPを処置することで、ハンチントン病のpolyQと筋強直性ジストロフィー1型のCUG RNA凝集体の産生が有意に抑制された。
モデルマウスの行動学的・電気生理学的・生化学的・組織学的な神経病態を劇的に抑制
個体における薬効評価を行うため、アデノ随伴ウイルスを介したCAG/CTGリピート脳内発現マウスおよび遺伝子改変ハンチントン病モデルマウスにおいて、CWG-cPIPが神経機能障害を抑制するか検討した。行動学的・電気生理学的・生化学的および組織学的な多角的解析結果より、CWG-cPIPは、細胞レベルだけでなくマウス個体レベルでも劇的にハンチントン病と筋強直性ジストロフィー1型の神経病態を抑制することが証明された。
高い細胞内移行性・安全性・疾患特異性についても確認
創薬研究において、使用する化合物の細胞内移行性・安全性・疾患特異性は極めて重要な項目として挙げられる。蛍光標識したCWG-cPIPは、マウス脳室内への投与後、ドラッグデリバリーシステムを使用せずに脳内の細胞核で長期間(7日間以上)観察された。培養細胞におけるCWG-cPIPの細胞毒性を調べたところ、有効濃度の30倍で長時間処置しても細胞生存率に全く影響しなかった。また、ヒト線維芽細胞とマウス脳組織においてCWGcPIPのオフターゲット効果は観察されなかった。さらに、CWG-cPIPは遺伝子改変ハンチントン病モデルマウスの伸長CAGリピート由来のRNAの産生を有意に抑制するが、正常CAGリピート由来のRNA産生には影響を与えないことがわかった。
さまざまな配列のリピート伸長に合わせて設計・合成可能
リピート伸長病は、ハンチントン病や筋強直性ジストロフィー1型などのCAG/CTGリピート伸長だけでなく、疾患ごとに異なる3~6塩基のさまざまな配列のリピート伸長が発症要因となる。(例えば、GGGGCCリピート伸長による筋萎縮性側索硬化症、CGGリピート伸長による脆弱X症候群関連疾患や神経核内封入体病、AAGGGリピート伸長による小脳性運動失調・ニューロパチー・前庭反射消失症候群など)。PIポリアミドは、標的とするDNA配列に合わせてピロールとイミダゾールの配置を変えて設計・合成することで、標的遺伝子に特異的に結合する高い汎用性を備えている。「『高い細胞膜透過性』、『高い安全性』、『リピート長依存性(疾患特異性)』、『高い汎用性』を示すPIポリアミドは、リピート伸長病の疾患ごとにテーラーメイド医療を実現できる創薬基盤となる」と、研究グループは述べている。
▼関連リンク
・熊本大学 お知らせ




