DMD骨格筋におけるAMSCsの炎症制御作用に着目
東京大学医科学研究所は9月26日、羊膜間葉系間質細胞(Amnion-derived mesenchymal stromal cells:AMSCs)を用いたデュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy:DMD)に対する抗炎症細胞療法の有用性を明らかにしたと発表した。この研究は、同大大学院医科学研究所分子遺伝医学分野の岡田尚巳教授、笠原優子特任助教と、株式会社カネカ再生・細胞医療研究所の上田恭義所長らによる研究グループによるもの。研究成果は、「Stem Cell Research & Therapy」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
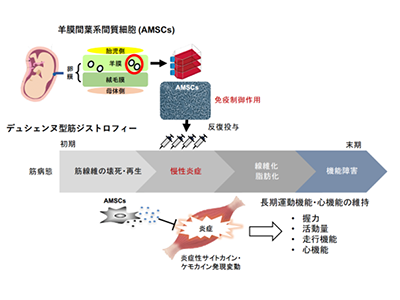
DMDは、筋疾患の中でも最も発症頻度が高く(およそ3,500分の1男児)、ジストロフィン完全欠損により慢性炎症を伴う進行性の筋機能障害を認め、呼吸不全や心筋症に至る重篤な遺伝性疾患。遺伝子治療などによるジストロフィン回復を目的とした根本治療が有望とされる一方、骨格筋組織における慢性炎症は機能障害を促す要因とされている。ステロイドによる対症療法は、効果の個人差や長期服用による副作用の観点から、慢性炎症を標的とする新たな治療法の開発が望まれる。
羊膜間葉系間質細胞(AMSCs)は、骨髄などと比べて組織含有細胞数が非常に多いため、同一ロットからの採取・拡大培養が容易だ。また、幼若組織由来であるため細胞増殖能が旺盛で、継代培養においても染色体構造の安定性が高いことが利点として挙げられる。すでに移植片対宿主病に対する細胞製剤として販売されている骨髄MSCsと類似した免疫制御作用を有することから、研究グループはDMD骨格筋におけるAMSCsの炎症制御作用に着目した。
hAMSCsによる炎症制御とその後の筋線維壊死の抑制効果をモデルマウスで確認
まず、末梢血単核球(PBMC)と共培養したヒト由来AMSCs(hAMSCs)は、プロスタグランジンE2:PGE2)産生を介して抗炎症性M2マクロファージ(MΦ)の活性化を促進することを明らかにした。hAMSCsとDMDモデルmdxマウス由来骨格筋細胞を共培養したところ、これまでに骨髄MSCsによるM2MΦ活性化の際に発現増加が知られているサイトカイン・ケモカインと同じ分泌因子がhAMSCsから誘導された。hAMSCsにおいてもDMD環境下で、骨髄MSCsと同様の機序でM2MΦの活性化を促す可能性が示唆された。
そこで、幼若期のmdxマウスへhAMSCsを尾静脈内投与(週1回、4度)し、炎症制御や運動機能における治療効果を検証した。hAMSCs投与マウスにおける前脛骨筋の病理像は、未治療マウスと比べて細胞浸潤領域が限定的で筋線維間の間隙が狭く、軽症の傾向を示した。また、未治療マウスで認められるような広範囲なMΦ(F4/80)かつCD206は、陰性の浸潤は治療マウスでは認められず、多くがM2MΦ(CD206陽性)であることが判明した。さらに、治療マウスは炎症による筋線維の壊死に続き、再生した中心核線維の割合が減少したことから、hAMSCsによる炎症制御とその後の筋線維壊死の抑制効果が明らかとなった。
治療マウスの長期的な運動機能維持効果確認、走行持久力も有意に改善
この時、治療マウスの横隔膜ではインターロイキン(IL)-1受容体アンタゴニスト(IL-1Ra)、前脛骨筋ではTIMP-1(Tissue inhibitor of metalloproteinase-1)の発現が増加し、反対にインターロイキン(IL)-6値が減少することから、治療マウス骨格筋における炎症制御や組織修復に伴う微小環境の変動が認められた。治療マウスはhAMSCs投与4週後~40週以上経過しても握力が維持されており、長期にわたる運動機能の維持効果を示した。
次に、ホイール回転数による自発運動量を測定したところ、治療マウスの走行速度は未治療マウスと同じ程度だったが、1日あたりの走行距離と夜間の活動量が増加していた。治療マウスは、未治療マウスと比べて1分あたりの持続走行距離が長いことから、走行の持久力が有意に改善していることが明らかになった。
hAMSCsの活用で、DMD病態進行を遅延させる新規細胞治療の開発に期待
今回、研究グループがMSCsの炎症制御作用を活用した細胞移植の基盤研究を推進する中で、hAMSCsを投与したDMDマウスの病態緩和・炎症の鎮静化・運動機能における治療効果が初めて立証された。
hAMSCsを活用することで、DMD病態進行を遅延させる新たな細胞治療法の開発が期待されると、研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース




