HCVによる鉄代謝異常で引き起こされる傷害、詳細な分子機構は未解明
浜松医科大学は9月15日、C型肝炎患者における肝臓への鉄沈着に関わる2つの分子機構を明らかにしたと発表した。この研究は、同大学微生物学・免疫学講座の鈴木哲朗教授らの研究グループによるもの。研究成果は、「PLOS Pathogens」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
C型肝炎ウイルス(HCV)は1989年に発見された1本鎖RNAウイルスで、肝臓への慢性感染により肝硬変や肝細胞がんの原因となる。C型肝炎患者における鉄代謝異常、肝臓への鉄沈着は広く知られており、過剰な鉄、特に鉄(II)イオンは細胞内の活性酸素種の産生に深く関与し、フェントン反応によって生じたヒドロキシラジカルは脂質過酸化やDNA傷害を引き起こすことがわかっている。しかしながら、HCV感染がなぜ鉄蓄積につながるのかやその詳細な分子機構については十分に解明されていない。研究グループはいまだ十分に明らかにされていないHCV感染に起因する鉄代謝異常の分子機構の解明を目的とした。
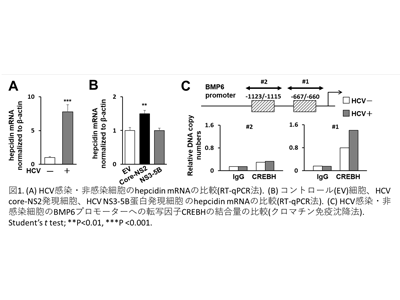
転写因子CREBHが2つのプロモーターに結合、鉄代謝調節ホルモンhepcidin誘導
HCV感染細胞およびHCV core-NS2タンパク質発現細胞では、鉄代謝調節ホルモンであるヘプシジン(hepcidin)のmRNA発現上昇がみられた。このhepcidin転写誘導において、転写因子CREBHがhepcidinプロモーターだけでなくBMP6プロモーターにも結合し、BMP6を介したhepcidinの誘導経路を新たに見出した。
HCVのNS3-4Aプロテアーゼ、鉄放出に関わるFPN1タンパク質分解を促進
HCV感染細胞ではhepcidin発現亢進により鉄輸送膜タンパク質であるFPN1タンパク質の分解促進がみられるが、HCV感染細胞およびNS3-4Aプロテアーゼ発現細胞においてFPN1の部分断片がhepcidin非依存的に検出されることを見出した。さらにこのFPN1断片がNS3-4Aプロテアーゼによって切断されたものであることをN末端アミノ酸解析により明らかにし、FPN1の切断によって細胞内鉄量の増加がみられたことからFPN1の鉄輸送能が失活したと考えられた。
ヒトとマウスのFPN1は相同性が高く、ヒトおよびマウスFPN1にNS3-4Aプロテアーゼの認識配列が共通して存在する。マウス肝臓へのHCVCore-NS2とNS3-4Aの発現によりそれぞれhepcidinの誘導とFPN1の切断がみられ、肝臓にはベルリンブルー染色で陽性となる鉄沈着が確認されたが、Core-NS2およびNS3-4Aの共発現によりさらに鉄沈着量が増加することを見出した。
鉄蓄積により肝不全および肝発がんが引き起こされる分子機構の解明に期待
今回の研究では、C型肝炎ウイルス感染による鉄蓄積において、その原因となる小胞体ストレスによるhepcidin誘導とNS3-4Aプロテアーゼの重要な役割を発見した。「C型肝炎に対する抗ウイルス療法の治療成績は2014年に直接作用型抗ウイルス薬の登場により飛躍的に向上したが、ウイルス排除後も病勢の進行や肝発がんに至る症例が散見され、いまだに多くの問題を抱えている。今後の研究で鉄蓄積が肝不全および肝発がんに寄与する分子機構が解明されることが期待される」と、研究グループは述べている。
▼関連リンク
・浜松医科大学 報道発表




