肺に形成される「転移前ソイル」、フィブリノーゲン沈着との関連は?
信州大学は8月25日、血清アミロイドタンパク質の遺伝子群をヒト化した動物の研究を行い、肺では、ヒトの病的フィブリノーゲンと血清アミロイドの複合体が沈着した場所に、がん細胞が転移することを確かめたと発表した。この研究は、同大先鋭領域融合研究群バイオメディカル研究所の平塚佐千枝教授らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がんは、国内の死亡原因第1位である。男性、女性ともに、おおよそ2人に1人が一生のうちにがんと診断され、男性ではおおよそ4人に1人、女性ではおおよそ6人に1人ががんで死亡すると言われている。
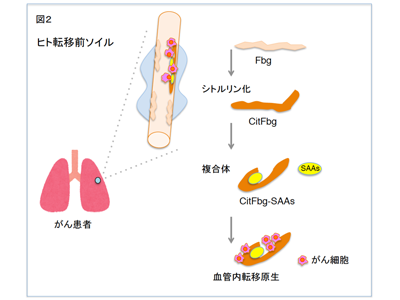
がん細胞が転移するにあたって、原発巣、転移巣、つまりがん細胞が存在する影響はかなり解析が進んでいるが、がん細胞は転移先をどのように選ぶのかについては不明な点が多いのが現状である。動物モデルでは、がんは転移する前にすでに遠隔の臓器に転移に有利な土壌を作成することが明らかになっている。さらに原発がんより分泌される因子によって、肺において炎症類似反応が引き起こされ、転移向性の土壌が形成される。これを転移前ソイルと呼ぶ。このソイルの血管は透過性が亢進し、その反応を止めようとして、凝固系の中間産物のフィブリノーゲンが沈着する。このフィブリノーゲンの沈着は、死亡したがん患者の肺にも観察されていた。ヒトにおける病変部位の観察は、貴重な知見だが、本当にこの部位にがん細胞が転移するかは、転移モデルマウスにおいての関連分子を明らかにし、それをヒトの分子に置き換えて、ヒトのがん細胞が転移するかを確かめる必要がある。
ヒト化マウスでフィブリノーゲンとSAAs複合体沈着した血管に転移結節の形成を確認
今回研究グループは、がんで死亡した患者(がん患者)と、がん以外の疾患で死亡した患者(非がん患者)の肺の標本より、フィブリノーゲンの沈着した血管をレーザーマイクロダイセクション法により収集し、RNAを抽出して遺伝子発現を比較した。がん患者の血管では血清アミロイド遺伝子群(SAAsクラスター遺伝子)の発現上昇が認められた。この遺伝子クラスターは、マウスとヒトで類似保存されているが、異なる部分もあるため、マウスとヒトの遺伝子を入れ替え、ヒト化マウスを作製した。このマウスにヒトのがん細胞を移植するためには、免疫不全マウスにする必要があるため、さらにRag1-/-のバックグラウンドの動物を作製し、転移実験を行った。ヒトフィブリノーゲンとSAAs複合体が沈着した限局した血管に、ヒトがん細胞は生着し、最終的に転移結節を形成した。生化学的実験から、このフィブリノーゲンには、転写後修飾の一つである、シトルリン化のタンパク質修飾がおきていることがわかった。次に転移を抑制するため、シトルリン化フィブリノーゲンへの機能ブロックペプチドを投与し、動物モデルで転移抑制ができた。
ヒトシトルリン化フィブリノーゲン特異的抗体を用い、がん患者の剖検肺から転移前ソイル検出
ヒトにおいてシトルリン化フィブリノーゲン-SAAs複合体の集積場所である、転移前ソイルの検出を試みた。ヒトシトルリン化フィブリノーゲン特異的抗体を作製し、がん患者の剖検肺において、限られた場所の血管に複合体沈着を認めた。ヒトにおける転移ソイルの1つの要因として、血管内にシトルリン化フィブリノーゲン-SAAs複合体が形成されると、がん細胞はここを足場として生着し、血管から組織に浸潤して転移を起こすことがわかった。
侵襲なくがん転移前や極早期転移を調べる方法につながる可能性
「患者の場合、原発のがんが見つかっても、兆候のない正常な部分を採取して調べる事は行われない。今後このヒト化動物モデルを用いて、肺のシトルリン化フィブリノーゲン-SAAs複合体を個体レベルで検出することを目指す。特異性と感度を上げることにより、将来患者のがん転移の前や極早期転移を、侵襲がない状態で調べ、予防的な治療ができる可能性が見込まれる」と、研究グループは述べている。




