炎症の収束に関わる代謝パスウェイは?
東北大学は8月22日、マクロファージによる炎症反応の収束には「硫黄代謝」の活性化が鍵となることを明らかにしたと発表した。この研究は、同大大学院医学系研究科の武田遥奈大学院生、加齢医学研究所環境ストレス老化研究センターの村上昌平助教、遺伝子発現制御分野の関根弘樹講師、本橋ほづみ教授らの研究グループと、熊本大学大学院生命科学研究部微生物学講座の澤智裕教授、九州大学生体防御医学研究所附属高深度オミクスサイエンスセンターの馬場健史教授、新潟大学医学部保健学科の佐藤英世教授、東北大学大学院医学系研究科環境医学分野の赤池孝章教授との共同研究によるもの。研究成果は、「Redox Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
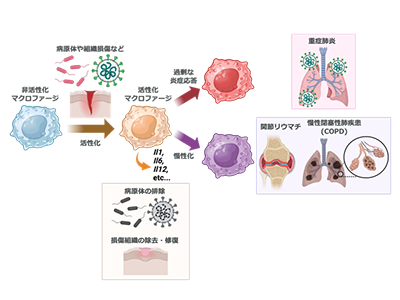
マクロファージは感染や組織損傷に応答して活性化し、IL-6やIL-1βといったさまざまなサイトカインを放出する。この活性化は病原体の排除、組織修復に重要である一方、過剰な活性化や長引く活性化は重症感染症や慢性炎症性疾患、自己免疫疾患といった病態の形成に関与する。近年、世界中の研究者により、活性化した免疫細胞では代謝産物のダイナミックな変動が起こること、そして、それはエネルギー需要の増加を満たすだけでなく、炎症反応をさまざまに制御することが明らかにされている。
一方、炎症収束を制御する因子としては、これまで炎症促進性サイトカインのmRNAを分解してその発現を抑制するRegnase-1タンパク質などが知られていたが、炎症の収束に関わる代謝パスウェイについては、十分に理解されていなかった。
活性化マクロファージで増加していた代謝物に「硫黄」を含むものが多いと判明
研究グループはまず、リポポリサッカライド(LPS)で刺激し、起炎症反応を誘導した腹腔内マクロファージ(以下、活性化マクロファージ)と、無刺激のマクロファージで代謝産物を網羅的に検出するメタボローム解析を行った。
活性化マクロファージで増加していた代謝物には、これまでに炎症反応を制御することが知られていたイタコン酸、コハク酸といった代謝物だけでなく、酸化型グルタチオンやシステインの酸化体など、硫黄を含む代謝物が多く含まれていることを見出した。
xCTを介した硫黄の取り込みが炎症反応の「収束」に必要
活性化マクロファージでは、含硫アミノ酸であるシスチンを細胞外から取り込むトランスポーター「xCT」の発現が著増する。そこで、xCT欠損マクロファージを用いてメタボロミクス解析を行ったところ、予想通り、それまでみられた硫黄代謝産物の変動が消失した。このマクロファージを用いてLPS刺激後の起炎症性サイトカインの変動を観察したところ、野生型マクロファージではLPS刺激後一過性にサイトカインが増加し、その後低下する一方、xCT欠損マクロファージでは炎症性サイトカインの増加が持続することが判明した。この結果は、xCTを介した硫黄の取り込みが、炎症反応の「収束」に必要であることを示している。
xCTを介した硫黄の取り込みが、超硫黄産生を介して炎症反応を収束
さらに、近年開発された超硫黄メタボローム解析技術を用いて、細胞内の硫黄代謝物の詳細なプロファイリングを行ったところ、LPS刺激後に複数の超硫黄分子が増加することを見出した。
そこで、細胞内で超硫黄分子を増加させることが知られている化合物であるNAC-S2をxCT欠損マクロファージに添加したところ、サイトカインの増加が抑制されることが明らかになった。これは、xCT欠損マクロファージで観察された炎症応答の遷延化は超硫黄分子の減少が原因であり、xCTを介した硫黄の取り込みが、超硫黄産生を介して炎症反応を収束させていることを示している。
マクロファージにおける硫黄代謝促進が炎症緩和の有効な治療標的となる可能性
今回の研究成果により、マクロファージは炎症刺激により活性化すると同時に、xCTを介したシスチンの取り込みと、それに続く超硫黄分子の産生を増加させることで、活性化にブレーキをかける「ネガティブフィードバック機構」を備えていることが明らかにされた。
「これは、超硫黄分子の産生をもたらす硫黄代謝が自然免疫制御の鍵を握ることを明らかにした画期的な報告だ。マクロファージにおける硫黄代謝の促進は、炎症の緩和をもたらす有効な治療標的となることが期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



