融合遺伝子産物が核内に形成する相分離構造体、その意義は?
国立医薬基盤・健康・栄養研究所(NIBIOHN)は8月3日、急性白血病細胞で見られるヌクレオポリン融合遺伝子産物が形成する核内の相分離構造体の新しい機能を明らかにしたと発表した。この研究は、同研究所創薬デザイン研究センター・細胞核輸送ダイナミクスプロジェクトの岡正啓プロジェクトリーダーらと、九州大学生体防御医学研究所の大川恭行教授のグループ、東京大学定量生命科学研究所の中戸隆一郎准教授のグループなどとの共同研究によるもの。研究成果は、「Cell Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
2つの異なる遺伝子が染色体の転座により融合して形成される融合遺伝子は、がんなどさまざまな病態で見出され病気の原因となることが知られている。核膜孔の構成因子であるタンパク質(ヌクレオポリン)「NUP98」や「NUP214」の遺伝子は、白血病の患者においては転写因子などさまざまなパートナーとなるタンパク質の遺伝子と融合遺伝子(以下、ヌクレオポリン融合遺伝子)を形成することが知られている。
これまでヌクレオポリン融合遺伝子の発現により、白血病細胞の増殖や維持に重要なホメオティック(HOX)遺伝子群など特定の遺伝子が活性化されることがわかっていた。またヌクレオポリン融合遺伝子から作られるタンパク質(融合遺伝子産物)の特徴として、「液液相分離」と呼ばれるプロセスにより、細胞核内で特徴的な構造体(以下、相分離構造体)を形成することが知られていた。しかし、相分離構造体の形成がどのように遺伝子発現活性化に関与しているのか、そのメカニズムは不明だった。
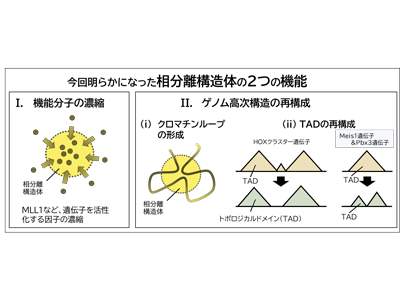
機能分子の濃縮、ゲノム高次構造の再構成という2つの機能を発見
研究グループは、核膜孔の構成因子であるタンパク質「NUP98」と転写因子であるタンパク質「HOXA9」のそれぞれの遺伝子が融合された融合遺伝子の産物(NUP98::HOXA9)が形成する相分離構造体には、機能分子の濃縮、ゲノム高次構造の再構成、という2つの機能があることを見出した。
機能分子の濃縮については、遺伝子の転写活性化に働くヒストン修飾酵素「MLL1」が相分離構造体の内部に高濃度に濃縮された状態で機能していること、また、「MLL1」の濃縮が、融合遺伝子産物「NUP98::HOXA9」の形成する相分離構造体のみならず、「ヒストンシャペロンSET」と「NUP214」の融合遺伝子産物「SET::NUP214」が形成する相分離構造体でも見られることが明らかになった。
ゲノム高次構造の再構成については、ヌクレオポリン融合遺伝子産物「NUP98::HOXA9」が結合する部位ではクロマチンループが形成されていること、トポロジカルドメイン(TAD)と呼ばれるゲノム高次構造が再構成されていることが明らかになった。
「これらの2つの機能により、相分離構造体がHOX遺伝子群など白血病に関わる遺伝子の選択的な活性化を促して病態に寄与していることが示唆される。今後の新規治療薬の開発などにつながることが期待される」と、研究グループは述べている。
▼関連リンク
・国立医薬基盤・健康・栄養研究所 プレスリリース



