正常な免疫細胞がCD47の発現で免疫細胞の攻撃から逃れるメカニズムは不明だった
神戸大学は8月8日、免疫反応の司令塔である樹状細胞が、リンパ球の表面に発現するCD47という分子を認識することでリンパ球の生存を制御することを明らかにしたと発表した。この研究は、同大大学院医学研究科の齊藤泰之講師、小森里美学術研究員、的崎尚特命教授らの研究グループによるもの。研究成果は、「米国科学アカデミー紀要」にオンライン公開されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ヒトの体を病原体から守っている免疫細胞には、自分自身(自己)と病原体(非自己)を見分ける仕組みが備わっている。中でも、自然免疫細胞の一種である樹状細胞は、細胞の表面に発現するさまざまな受容体を介して生体内に侵入した病原体を認識することで、病原体を排除する強力な免疫反応が誘導される。一方で、樹状細胞が自己由来の細胞をどのように認識するのか、さらにはその自己を認識する機構の破綻によって、どのような免疫反応が生じるのかについて、詳細は明らかになっていない。
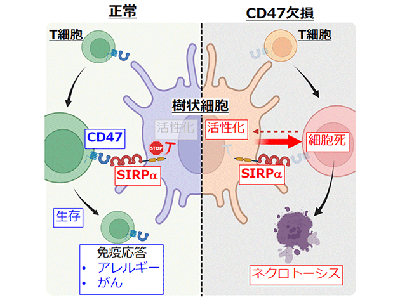
これまでに研究グループは、樹状細胞の表面に発現するSIRPα(サープアルファ)と呼ばれる分子を発見し、SIRPαがCD47という分子と結合(細胞間の情報のやり取りを担うCD47–SIRPα系を形成)することで、さまざまな免疫応答に関与することを見出していた。一方、正常な免疫細胞は細胞表面にCD47を発現することで免疫細胞からの攻撃から逃れることが想定されていたものの、その詳しい仕組みについてはこれまで明らかになっていなかった。
T細胞のみでCD47欠損のマウス、末梢T細胞数が著しく減少
今回研究グループは、免疫応答の中心であるT細胞の生存の制御機構に注目した。T細胞はリンパ球の一種で感染細胞やがん細胞を殺すキラーT細胞や他の細胞による免疫応答を助けるヘルパーT細胞に分けられる。これらのT細胞は脾臓やリンパ節の中に留まっており、樹状細胞から自己や病原体由来の情報を受け取る。研究グループが、T細胞のみにCD47を欠損させた遺伝子改変マウス(Cd47ΔTマウス)を作製したところ、脾臓やリンパ節内のT細胞の数が著しく減少していることが判明した。
そこで、T細胞の減少の原因を調べるため、Cd47ΔTマウスのT細胞の形態や遺伝子の発現を解析したところ、Cd47ΔTマウスのT細胞は細胞死の一つであるネクロトーシスによる細胞死が生じていることが明らかとなった。
樹状細胞との直接の相互作用により、CD47欠損T細胞にネクロトーシス誘導
全身性にCD47を欠損させたマウスではこのようなT細胞特異的な細胞死を認めないことから、T細胞以外の細胞、特に樹状細胞がCd47ΔTマウスのT細胞に対してネクロトーシスを誘導している可能性が考えられた。そこで、実際に樹状細胞とT細胞を共培養したところ、樹状細胞との直接の相互作用によってCD47欠損T細胞に対してネクロトーシスが誘導されることが明らかになった。
さらに、このT細胞の減少が実際の免疫応答にどのような影響を与えるかを調べる目的で、接触性皮膚炎モデルならびにがんモデルを用いて検討を行った。その結果、Cd47ΔTマウスは接触性皮膚炎の発症に抵抗性を示しただけでなく、皮下に移植したがんが著しく増大したという。
CD47とSIRPαを標的とした新規がん治療薬の開発につながる重要な発見
今回の研究結果により、樹状細胞がT細胞上に発現するCD47を見分けることにより、正常T細胞に対しては生存を、CD47を発現していないT細胞に対しては細胞死を誘導することが判明した。この樹状細胞がT細胞の生存を制御することによって、T細胞による適切な免疫応答が誘導されることが示された。
現在、研究グループはCD47とSIRPαとの相互作用を標的とした新たながん治療薬の開発に取り組んでいる。このCD47–SIRPα系は樹状細胞やマクロファージががん細胞を攻撃する際の分子ブレーキ(免疫チェックポイント)として働くことが判明し、CD47–SIRPα系を標的とした薬剤は現在がんに対する新しい免疫療法として臨床試験が進められている。
「今回発見された樹状細胞による細胞死の誘導は、これまで想定されていた機序と全く異なるもので、今後のCD47とSIRPαを標的とした新規がん治療薬の開発につながる重要な発見であり、現在がん細胞に対しても同様な細胞死の誘導機構を有するかについて、さらに研究を進めている」と、研究グループは述べている。
▼関連リンク
・神戸大学 研究ニュース




