日本での治験の結果に基づき、RPDD指定、OD指定も
国立精神・神経医療研究センター(NCNP)は8月7日、日本新薬株式会社と共同で開発を進めてきたアンチセンス核酸医薬品であるデュシェンヌ型筋ジストロフィー(以下、DMD)治療薬(NS-089/NCNP-02)について、米国食品医薬品局(FDA)から、ブレイクスルーセラピー指定、希少小児疾患(RPDD)指定、オーファンドラッグ(OD)指定を受けたことを発表した。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ブレイクスルーセラピー指定は、重篤または生命を脅かす疾患の治療に対する薬剤の開発と審査の迅速化を目的とするFDAの制度。既存の治療法と比べて、臨床的に重要な評価項目で意義のある予備的な臨床エビデンスを示した薬剤がその対象となる。今回のブレイクスルーセラピー指定は、同センターで実施された医師主導治験(First in human試験)の結果に基づく。希少小児疾患指定は、米国で18歳までに発症し、患者数が20万人未満の重篤または生命を脅かす疾患がその対象となる。オーファンドラッグ指定は、米国内の患者数が20万人未満の疾患が対象となる。
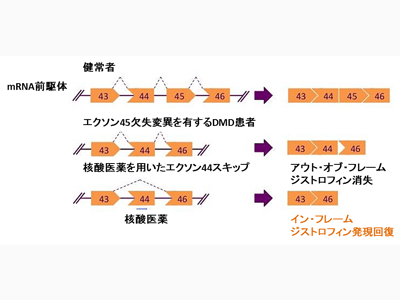
NS-089/NCNP-02はエクソン44スキップ薬
DMDは、筋肉細胞を支えるジストロフィンタンパク質の欠損が原因で、骨格筋、心筋、肺の筋力低下を引き起こす進行性の筋ジストロフィー。DMDにはさまざまな遺伝子変異型があり、NS-089/NCNP-02の投与対象となるのは、エクソン44スキッピングにより治療可能な遺伝子変異が確認されたDMD患者である。
この治療でスキップの対象となるエクソンは患者の変異形式に応じて異なり、現在までに、日本では、NCNPと日本新薬が共同で見出したNS-065/NCNP-01を有効成分としたエクソン53スキップ薬である「ビルトラルセン静注」(製品名:ビルテプソ点滴静注250mg)が条件付き早期承認を取得している。一方、エクソン53スキップ薬が適応にならない患者に対して、別のエクソンを標的とした薬剤の開発が喫緊の課題となっていた。
NS-089/NCNP-02は、NCNPと日本新薬が共同で開発した世界初のエクソン44スキップ薬である。モルフォリノ核酸が本来有する高い安全性に加えて、特許出願技術である新規高活性配列探索法を用いて開発した配列連結型のモルフォリノ核酸製剤であり、高いエクソン・スキップ活性を有している。
医師主導治験では平均15.79%のジストロフィンタンパク質の発現回復
これまでに得られた非臨床試験の結果からは、エクソン44スキップに応答する変異形式のDMD患者細胞における薬効が確認されている。また、NCNP病院と鹿児島大学病院で実施した医師主導治験の結果からは、平均15.79%のジストロフィンタンパク質の発現の回復が認められ、ノース・スター歩行能力評価スコアを含め、運動機能の維持または改善傾向が示唆されており、DMDに対する治療効果が期待されている。
国際共同第2相試験の準備が進行中
米国での開発は、日本新薬の米国子会社NS Pharma, Inc.が実施する予定。なお、日本国内においても、NCNP病院の医師主導治験に参加した6人を対象に継続投与試験を日本新薬が実施中であり、新たに日本国内を含めた国際共同第2相試験の準備が進んでいる。
「今回のFDAによる3つの指定は、NS-089/NCNP-02が革新的な新規治療薬として有望であることを示していると認識している。難病・希少疾患治療剤の開発に引き続き使命感を持って取り組んでいきたい」と、研究グループは述べている。




