孤発性・家族性ALSの原因として報告のTDP-43
名古屋大学は8月7日、筋萎縮性側索硬化症(ALS)の発症に関わるメカニズムとして、TDP-43タンパク質の生理的な二量体化・多量体化が障害されて単量体化することが一因となっていることを解明したと発表した。この研究は、同大環境医学研究所病態神経科学分野の山中宏二教授、大学院医学系研究科神経内科学の大岩康太郎客員研究者(筆頭著者)、勝野雅央教授、愛知医科大学加齢医科学研究所神経iPS細胞研究部門/内科学講座(神経内科)の岡田洋平教授らの研究グループによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ALSは、運動ニューロンが選択的に障害を受ける進行性の神経変性疾患だ。全身の筋肉が萎縮して筋力が低下していき、身体を動かすことが難しくなり、発音や飲み込み、呼吸などもできなくなる。発症から2~5年で死亡する重篤な神経変性疾患の1つで、根本的な治療法は確立されていない。そのため、早期の病態解明および治療法の開発が望まれている。
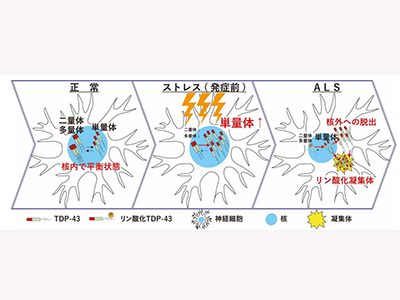
ALS患者の大部分は遺伝歴がなく、孤発性ALSと呼ばれる。ほぼ全ての孤発性ALS患者の脳や脊髄では「TDP-43病理」と呼ばれる変化がみられ、診断マーカーとされている。TDP-43病理とは、正常な運動ニューロンでは核内に存在するTDP-43タンパク質が、ALS患者の運動ニューロンでは核外の細胞質に脱出して異常にリン酸化された凝集体を形成している状態を指す。また、孤発性ALSだけでなく、家族性ALSでもTDP-43の遺伝子変異が原因として報告されている。これらの知見から、TDP-43タンパク質の変化がALSの病態において重要な役割を果たしていると考えられる。しかし、なぜTDP-43がこのような変化をきたすのか、特にその上流メカニズムはほとんど解明されていない。
近年、TDP-43がN末端ドメインを介して二量体化・多量体化しており、RNAスプライシングなどのTDP-43の生理的機能において重要であることが報告されている。しかし、TDP-43の二量体化・多量体化がどのようにALS病態へ関与しているのかについて、これまでよくわかっていなかった。
患者脳・脊髄でTDP-43単量体化を確認
今回の研究では、ALS患者の病変組織でTDP-43の二量体化・多量体化を2つの方法で評価した。まず、架橋剤を用いた免疫ブロット法で評価。その結果、ALS患者の脳組織および脊髄組織では、TDP-43の二量体化・多量体化が低下して単量体化していることがわかった。
次に、E2G6G抗体を用いてALS患者の脊髄運動ニューロンを免疫染色法で評価。E2G6G抗体は、単量体化したTDP-43のN末端ドメインを特異的に認識して染色できる抗体として、同研究グループが同定したものだ。正常な運動ニューロンの核内に存在するTDP-43は、E2G6G抗体でほとんど染色されない一方で、ALSの運動ニューロン内の病的凝集体は強く染色された。このことから、ALSの病的凝集体を構成するTDP-43のN末端ドメインが単量体化していることがわかった。
単量体変異体TDP-43を神経細胞に導入でALS病態を再現
続いて、二量体化・多量体化ができないように遺伝子変異を加えた単量体変異体TDP-43を、神経系培養細胞やヒトiPS細胞由来運動ニューロンに遺伝子導入した。その結果、単量体変異体TDP-43は核外へ脱出する傾向が見られ、リン酸化を伴う凝集体を形成した。これらの変化は、孤発性ALSの運動ニューロンで見られるTDP-43病理を再現していた。
さまざまなストレス条件下でTDP-43は単量体化、核内構造体Gemの破綻と密接に関係
最後に、研究グループは生細胞内でTDP-43の二量体化・多量体化を簡便・迅速に定量評価できる測定技術「TDP-DiLuc」を開発。この技術を用いて、ALSの病態に関与していると考えられているさまざまなストレスを与えた細胞におけるTDP-43の二量体化・多量体化を評価した。その結果、これら全てのストレス条件下でTDP-43は単量体化していることが判明。このTDP-43の単量体化は、RNAスプライシングに重要なGemと呼ばれる核内構造体の破綻と密接に関係していたという。
TDP-43単量体化がALS早期病態の可能性
細胞モデルを用いてTDP-43の経時的な変化を追跡したところ、これまで重要視されてきたTDP-43病理(核外への脱出・リン酸化を伴う凝集体)が形成されるよりも早期にTDP-43が単量体化していることを見出した。以上から、TDP-43の単量体化はALSにおけるTDP-43病理を誘発する上流のメカニズムであると考えられた。
ALS早期病態解明、バイオマーカー・新規治療法開発に期待
今回の研究により、TDP-43の単量体化がALSの早期病態において重要な役割を果たしていることが明らかになった。これまでTDP-43病理の上流メカニズムはほとんど未解明だったが、TDP-43の単量体化に着目することで、将来的にALSにおける早期病態解明、早期バイオマーカーの発見につながることが期待される。また、今回開発したTDP-DiLucを薬剤スクリーニングに応用することで、ALSの創薬研究につなげていきたいと考えている、と研究グループは述べている。
▼関連リンク
・名古屋大学 プレスリリース




